Rovnice beze změny oxidačního čísla
Neredoxné rovnice sú rovnice chemických reakcií, pri ktorých nedochádza k zmene oxidačného čísla žiadneho atómu. Na zisťovanie stechiometrických koeficientov v rovniciach neredoxných reakcií sa nedá použiť žiadny jednoduchý a zároveň univerzálny algoritmus. Chemici pristupujú k riešeniu neredoxných rovníc zo začiatku väčšinou metódou pokus-omyl, neskôr vylepšenou empíriou, teda na základe skúseností. Riešenie však vždy musí vyhovovať všeobecným pravidlám na výpočet stechiometrických koeficientov.
- Na začiatku nájdeme v chemickej rovnici látku (reaktant alebo produkt), ktorej vzorec má najväčšie stechiometrické indexy (resp. obsahuje najväčší počet atómov). Stechiometrický koeficient tejto látky budeme považovať za jednotkový.
- Potom pridáme koeficienty pred látky, ktoré obsahujú rovnaké atómy ako látka s prideleným jednotkovým koeficientom (podľa pravidla bilancie počtu atómov, prípadne podľa pravidla bilancie nábojových čísiel).
- Postupne pridávame koeficienty pred látky, ktoré ešte nemajú priradené koeficienty na základe počtu atómov v látkach, ktoré už koeficienty majú (opäť podľa pravidla bilancie počtu atómov, prípadne podľa pravidla bilancie nábojových čísiel).
- Ako predposledné zisťujeme počty atómov vodíka a podľa potreby doplníme stechiometrické koeficienty.
- Ako posledné zistíme počty atómov kyslíka na oboch stranách rovnice. Táto operácia nám obvykle slúži na kontrolu už získaných koeficientov.
1. Vyčíslite nasledujúce chemické rovnice:
Riešenie:
- a) Na ľavej strane sa chlór aj vodík nachádzajú po dvakrát. Podľa zákona zachovania počtu atómov sa musí rovnaký počet nachádzať aj na pravej strane, preto napíšeme pred HCl číslo 2. Výsledná rovnica teda vyzerá takto:
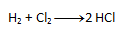
- b) Na pravej strane sa chlór nachádza dvakrát, no na ľavej strane len raz. Preto napíšeme pred HCl číslo 2. Počet ostatných prvkov potom „sedí“ na oboch stranách.
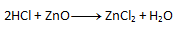
2. Vyčíslite nasledujúce chemické rovnice:
Riešenie:
- a) 1,1,1,1
- b) 1,3,2
- c) 2,3,1,6
- d) 1,6,2,3
- e) 2,1,1,1
- f) 1,2,1,2,2
- g) 1,1,1,1
- h) 1,1,1,1
- i) 1,1,1,1
3.Doplňte stechiometrické koeficienty pri nasledujúcich rovniciach:
Riešenie:
- a) 4,1,4,2
- b) 1,3,2
- c) 1,6,2,3
- d) 1,1,1,1
- e) 1,4,1,2
- f) 2,1,1,1,1
- g) 1,2,2,1
- h) 1,3,1,3
4. Doplňte stechiometrické koeficienty do rovníc:
- Riešenie:
- a) 1,3,3,2
- b) 1,6,2,3
- c) 2,2,5,1,2,14
- d) 1,1,1,1,1,1
- e) 3,2,1,6
- f) 1,6,2,3
- g) 2,1,1,2
- h) 2,1,1,1
5. Zistite stechiometrické koeficienty v rovnici:
H3PO4 + CaCO3 → Ca3(PO4)2 + CO2 + H2O
Riešenie:
V chemickej rovnici zostávajú oxidačné čísla všetkých atómov rovnaké, teda nie je redoxná. Pri zisťovaní stechiometrických koeficientov vyhľadáme látku, v ktorej vzorci sú najväčšie hodnoty stechiometrických indexov (obsahuje najväčší počet atómov). V našom prípade to je Ca3(PO4)2 (jeden z produktov). Predpokladajme, že jej stechiometrický koeficient má hodnotu 1 a vzhľadom na túto skutočnosť začneme priraďovať stechiometrické koeficienty reaktantom. Na pravej strane rovnice máme tri atómy vápnika a dva atómy fosforu, preto pred CaCO3 dáme koeficient 3 a pred H3PO4 koeficient 2:
2H3PO4 + 3CaCO3 → Ca3(PO4)2 + CO2 + H2O
Stechiometrické koeficienty už majú všetky reaktanty a prvý produkt. Zostávajúcim produktom dáme stechiometrické koeficienty na základe počtu atómov uhlíka (pre CO2) a vodíka (pre H2O). Na ľavej strane máme tri atómy uhlíka, preto na pravej strane dáme pred CO2 koeficient 3. Na ľavej strane rovnice máme šesť atómov vodíka, preto pred H2O dáme koeficient 3. Správnosť priradených koeficientov overíme spočítaním atómov kyslíka na oboch stranách rovnice (17 = 17). Keďže získané stechiometrické koeficienty (2, 3 = 1, 3, 3) už okrem čísla 1 nemajú žiadneho spoločného deliteľa, vyčísľovanie chemickej rovnice je ukončené.
2H3PO4 + 3CaCO3 → Ca3(PO4)2 + 3CO2 + 3H2O
6. Zistite stechiometrické koeficienty v tejto rovnici:
V2O5 + HF + KOH + H2O2 + → K3[V2O2(O2)3F3]•HF•2H2O + H2O
Riešenie:
V chemickej rovnici zostávajú oxidačné čísla všetkých atómov rovnaké, teda nie je redoxná. Pri zisťovaní stechiometrických koeficientov vyhľadáme látku, v ktorej vzorci sú najväčšie hodnoty stechiometrických indexov (obsahuje najväčší počet atómov). V našom prípade to je prvý produkt: K
3[V
2O
2(O
2)
3F
3]•HF•2H
2O. Predpokladajme, že jeho stechiometrický koeficient bude 1. Vzhľadom na túto skutočnosť začneme prideľovať stechiometrické koeficienty reaktantom. V produkte sú dva atómy vanádu, preto pred V2O5 nedáme žiaden koeficient (t. j. bude tam koeficient 1). Zároveň máme na pravej strane tri atómy draslíka a štyri atómy fluóru, preto pred KOH dáme koeficient 3 a pred HF koeficient 4:
V2O5 + 4HF + 3KOH + H2O2 → K3[V2O2(O2)3F3]•HF•2H2O + H2O
Na pravej strane máme tri peroxidoligandy (t. j. (O2)3), preto pred H2O2 dáme koeficient 3.
V2O5 + 4HF + 3KOH + 3H2O2 → K3[V2O2(O2)3F3]•HF•2H2O + H2O
Zostáva nám už len druhý produkt – voda. Keďže máme koeficienty pred všetkými reaktantmi a prvým z produktov, spočítame atómy vodíka v reaktantoch (4 + 3 + 6 = 13) a od získaného súčtu odpočítame počet atómov vodíka v prvom produkte (5). Výsledok (13 – 5 = 8) predstavuje počet atómov vodíka, ktoré sa musia byť viazané vo vode. Pred H
2O teda dáme koeficient 4.
V2O5 + 4HF + 3KOH + 3H2O2 → K3[V2O2(O2)3F3]•HF•2H2O + 4H2O
Správnosť stechiometrických koeficientov overíme spočítaním atómov kyslíka na oboch stranách rovnice (14 = 14). Keďže získané stechiometrické koeficienty (1, 4, 3, 3 = 1, 4) už okrem čísla 1 nemajú žiadneho spoločného deliteľa, vyčísľovanie chemickej rovnice je ukončené.
7. Zistite stechiometrické koeficienty v tejto rovnici:
K2SO4 + Cr2O3 + H2SO4 + H2O → KCr(SO4)2•12H2O
Riešenie:
V chemickej rovnici zostávajú oxidačné čísla všetkých atómov rovnaké, teda nie je redoxná. Pri zisťovaní stechiometrických koeficientov vyhľadáme látku, v ktorej vzorci sú najväčšie hodnoty stechiometrických indexov. V našom prípade je to jediný produkt – KCr(SO
4)2•12H
2O. Predpokladajme, že jeho stechiometrický koeficient bude 1. Na pravej strane tak bude jeden atóm draslíka. Na ľavej strane rovnice sú však v reaktante K2SO4 viazané dva atómy draslíka. Podobná situácia je aj pri atómoch chrómu. Preto svoj predpoklad musíme zmeniť – predpokladajme, že stechiometrický koeficient produktu bude 2. Potom na ľavej strane rovnice budeme mať dva atómy draslíka a dva atómy chrómu, takže K2
SO
4 aj Cr
2O
3 budú mať koeficient 1.
K2SO4 + Cr2O3 + H2SO4 + H2O → 2KCr(SO4)2•12H2O
Ďalej máme na pravej strane štyri atómy síry (môžeme povedať aj štyri síranové anióny – SO
42–, lebo zostali vcelku). Na ľavej strane obsahujú síru dva reaktanty: K
2SO
4 a H
2SO
4. Keďže pred K
2SO
4 sme už dali koeficient 1 a táto látka obsahuje jeden atóm síry, pred H2SO4 dáme koeficient 3:
K2SO4 + Cr2O3 + 3H2SO4 + H2O → 2KCr(SO4)2•12H2O
Zostal nám jediný reaktant – voda. Na pravej strane máme 2 • 12 • 2 = 48 atómov vodíka. Na ľavej strane obsahujú vodík dva reaktanty – H
2SO
4 a H
2O. Keďže H
2SO
4 už má pridelený koeficient, z rozdielu medzi požadovaným počtom atómov vodíka a počtom atómov vodíka viazaných v 3H
2SO
4 (6) zistíme, koľko atómov vodíka musí prinášať posledný reaktant – voda: 48 – 6 = 42. Takéto množstvo atómov vodíka obsahuje 21 molekúl vody, preto pred H
2O dáme koeficient 21.
K2SO4 + Cr2O3 + 3H2SO4 + 21H2O → 2KCr(SO4)2•12H2O
Správnosť stechiometrických koeficientov overíme spočítaním atómov kyslíka na oboch stranách rovnice (40 = 40). Keďže získané stechiometrické koeficienty (1, 1, 3, 21 = 2) už okrem čísla 1 nemajú žiadneho spoločného deliteľa, vyčísľovanie chemickej rovnice je ukončené.
8. Zistite stechiometrické koeficienty v nasledujúcej chemickej rovnici:
Riešenie:
V chemickej rovnici sa oxidačné čísla všetkých atómov nemenia, takže nie je redoxná. Vyhľadáme látku, ktorá má najväčšie stechiometrické indexy a budeme predpokladať, že jej stechiometrický koeficient sa rovná 1. V našom prípade ide o P4O10. Na pravej strane rovnice teda máme štyri atómy fosforu, preto pred produkt dáme koeficient 4:
P4O10 + H2O → 4H3PO4
Jedinou látkou, ktorá nemá určený stechiometrický koeficient, je voda. Keďže na pravej strane máme 12 atómov vodíka a na ľavej strane sa vodík nachádza len vo vode, pred molekulu vody dáme koeficient 6, čím získame na oboch stranách rovnice rovnaký počet atómov vodíka:
P4O10 + 6H2O → 4H3PO4
Týmto sme získali koeficienty pre všetky látky v rovnici. Správnosť stechiometrických koeficientov overíme spočítaním atómov kyslíka na oboch stranách rovnice (16 = 16).
9. Zistite stechiometrické koeficienty v nasledujúcej chemickej rovnici:
HCOOH + MgO → (HCOO)2Mg + H2O
Riešenie:
V chemickej rovnici sa oxidačné čísla všetkých atómov nemenia, takže nie je redoxná. Ide o reakciu organickej kyseliny (kyseliny mravčej alebo metánovej) s oxidom horečnatým. Vyhľadáme látku, ktorá má najväčšie stechiometrické indexy (najväčší počet atómov) a budeme predpokladať, že jej stechiometrický koeficient sa rovná 1. V našom prípade ide o produkt – (HCOO)
2Mg. Na pravej strane rovnice teda máme jeden atóm horčíka, preto na ľavej strane bude koeficient MgO tiež jeden. Na pravej strane rovnice máme dva atómy uhlíka (resp. dva mravčanové anióny), preto koeficient na ľavej strane pred HCOOH bude 2:
2HCOOH + MgO → (HCOO)2Mg + H2O
Jedinou látkou, ktorá nemá určený stechiometrický koeficient je voda. Na ľavej strane máme 4 atómy vodíka (2HCOOH), na pravej strane sa vodík nachádza v oboch produktoch a tiež sú tam spolu 4 atómy vodíka, takže pred H
2O musí byť koeficient 1.
Týmto sme získali koeficienty pre všetky látky v rovnici. Správnosť stechiometrických koeficientov overíme spočítaním atómov kyslíka na oboch stranách rovnice (5 = 5). Keďže získané stechiometrické koeficienty
(2, 1 = 1, 1) už okrem čísla 1 nemajú žiadneho spoločného deliteľa, vyčísľovanie chemickej rovnice je ukončené.