Hmotnosť látky
1. Vypočítajte hmotnosť v gramoch jednej molekuly vodíka a jedného atómu vodíka.
Riešenie:
Mólová hmotnosť molekulového vodíka (H2) je 2,016 g.mol-1. Po dosadení do rovnice pre výpočet mólovej hmotnosti dostaneme:
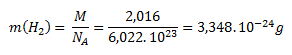
Mólová hmotnosť atómového vodíka (H) je 1,008 g.mol-1. Hmotnosť jedného atómu vodíka vypočítame analogicky ako pri molekule:
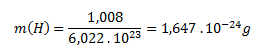
Hmotnosť jednej molekuly vodíka je 3,348 . 10-24g a jedného atómu vodíka 1,647 . 10-24 g.
2.Na pokus potrebujete presne 0,1 mol zinku. Akú hmotnosť zinku treba odvážiť?
Riešenie:
Vychádzame zo vzťahu pre mólovú hmotnosť. Mólová hmotnosť zinku z tabuliek je 65,38 g.mol-1.
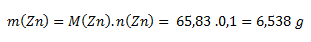
Je potrebné navážiť 6,538 g zinku.
3.Meď je zmesou izotopických nuklidov 63Cu a 65Cu. Hmotnosť atómov týchto nuklidov je: 63Cu= 62,929 u a 65Cu= 64,928 u (u predstavuje jednotky atómovej hmotnosti- číselná hodnota relatívnej atómovej hmotnosti prvku a hmotnosti jedného atómu daného prvku vyjadrená v atómových hmotnostných jednotkách je rovnaká). Ak relatívna atómová hmotnosť medi je 63,546, aké je percentuálne zastúpenie obidvoch nuklidov v zmesi?
Riešenie:
Uvedená relatívna atómová hmotnosť medi je stredná relatívna atómová hmotnosť a jej číselná hodnota závisí od percentuálneho zastúpenia obidvoch nuklidov v zmesi. Ak si označíme percentuálne zastúpenie nuklidov ako x a y, potom platia nasledujúce rovnice:
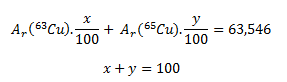
Pretože číselná hodnota hmotností atómov obidvoch nuklidov vyjadrená v atómových hmotnostných jednotkách (u) a hodnota relatívnej atómovej hmotnosti nuklidov je rovnaká, Ar (63Cu)= 62,929 a Ar(65Cu)= 64,928. Po dosadení týchto hodnôto do rovnice dostávame:
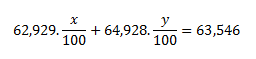
Za y dosadíme výraz y= 100-x
0,62929x+0,64928 (100-x)=63,546
Riešením rovnice dostávame pre percentuálne zastúpenie nuklidu 63Cu
x= 69,13 %
Zastúpenie nuklidu 65Cu
y=100-x=100-69,13=30,87%
V zmesi je 69,13 % nuklidu 63Cu a 30,87 % nuklidu 65Cu.
4.Vypočítajte počet častíc účinnej látky v homeopatickom lieku, ktorý vznikol cetezimálnym hahnemannským riedením CH12. To je postup, keď z roztoku materskej tinktúry odeberieme 1 diel roztoku a doplníme 99 dielmi čistého rozpúšťadla, premiešame a postup zopakujeme spolu dvanásťkrát (riedenie CH12). Materská tinktúra je zložená z 1 g NaCl rozpustenej v 1 litri destilovanej vody.
Prihláste sa pre zobrazenie riešenia
5. Určte chemický ekvivalent medi v oxide, v ktorom je meď zlúčená s kyslíkom v hmotnostnom pomere 3,971 : 1,000
Prihláste sa pre zobrazenie riešenia6.Aká musí byť hmotnosť vápnika, aby návažok obsahoval rovnaký počet atómov ako je v 10,00 g zinku?
Prihláste sa pre zobrazenie riešenia7.Prírodné lítium je zmesou nuklidov 6Li a 7Li s percentuálnym zastúpením 7,54 % a 92,46 %. Vypočítajte relatívnu atómovú hmotnosť nuklidu 7Li, ak viete, že relatívna atómová hmotnosť nuklidu 6Li je 6,016 a stredná relatívna atómová hmotnosť prírodného Li je 6,941.
Prihláste sa pre zobrazenie riešenia8.Hmotnosť jedného atómu istého prvku je 3,158 . 10-22 g. Vypočítajte relatívnu atómovú hmotnosť, resp. mólovú hmotnosť prvku a určite o aký prvok sa jedná.
Prihláste sa pre zobrazenie riešenia9.Vypočítajte látkové množstvo kryštálovej vody v 50,4 g heptahydrátu síranu železnatého.
Prihláste sa pre zobrazenie riešenia
10.Vypočítajte látkové množstvo:
- a) 5,32 . 1021 atómov ortuti (ako príklad 2.)
- b) 50 g ortuti (ako príklad 2.)
- c) bezvodého síranu vápenatého v 100g dihydrátu síranu vápenatého (ako príklad 9.)