Objem látky (+ stavová rovnica)
1. Vypočítajte objem, ktorý zaberá 2,55 mol metánu pri teplote 20°C a tlaku 100,5 kPa.
Riešenie:
n= 2,55 mol; T= 20°C, to zodpovedá 273,15 K; p= 100500Pa; R= 8,314 J.mol-1.K
Úlohu riešime pomocou stavovej rovnice upravenej na tvar: 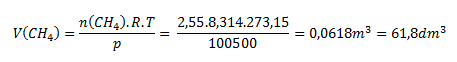
Pri daných podmienkach zaberá metán objem 61,8 l.
2. V plynojeme s objemom 50,00 m3 sa nachádza vodík (H2) pri teplote 25°C a tlaku 101300 Pa. Vypočítajte látkové množstvo vodíka v plynojeme.
Riešenie:
V= 50 m3; p= 101300 Pa; R=R= 8,314 J.mol-1.K; T= 25°C čo zodpovedá 298,15 K.
Stavovú rovnicu upravíme na tvar: 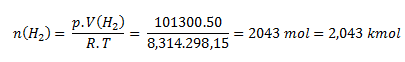
V plynojeme sa nachádza 2,043 kmol vodíka.
3.Reakciou vzniklo 19,72 dm3 acetylénu za normálnych podmienok. Vypočítajte jeho látové množstvo.
Riešenie:
Použijeme upravený vzťah pre normálny mólový objem látky: 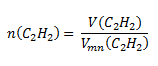
Do vzťahu dosadíme:
V (C2H2)= 19,72 dm3; Vmn (C2H2)= 22,41 dm3
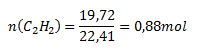
Reakciou vzniklo 0,88 mol acetylénu.
(Príklad možno riešiť aj logickou úvahou. Jeden mól ideálneho plynu zaberá 22,41 l. Naše množstvo zaberá iba 19,72 litra. Pre výpočet látkového množstva stačí dať do pomedu tieto dva údaje, teda 19,72/ 22,41, čo sa rovná 0,88 mol.
Možno zaznačiť do „trojčlenky“
1 mol ..........................22,41 dm3
x mol...........................19,72 dm3
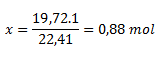
Reakciou vzniklo 0,88mol acetylénu)
4.V 20-litrovej tlakovej nádobe je vodík pod tlakom 101,97 kPa. Vypočítajte, ako sa zmení tlak v nádobe
- a) ochladením z teploty 20°C na -20°C
- b) zahriatím z 20°C na 50°C
5.O koľko sa zníži tlak kyslíka, ak sa trikrát zväčší jeho objem a stálej teploty?
Prihláste sa pre zobrazenie riešenia6.Objem plynu pri 27°C je 50 ml. Na akú teplotu treba zahriať plyn pri konštantnom tlaku, aby sa objem zväčšil na 200ml?
Prihláste sa pre zobrazenie riešenia7. Objem vodíka v nádobe nad vodou pri 27°C a za tlaku 107,59 kPa je 124 ml. Vypočítajte objem, ktorý by zaberal suchý vodík za normálnych podmienok. Parciálny tlak vodných pár pri teplote 27°C je 3,59 kPa.
Prihláste sa pre zobrazenie riešenia