Výpočet stechiometrického vzorce
1.Pri horení 3 g horčíka sa získalo 5 g oxidu horčíka. Vyjadrite zloženie tohto oxidu pomerom hmotností oboch prvkov.
Riešenie:
Pri horení horčíka sa spotrebovalo 5-3 = 2 g kyslíka. Zloženie oxidu horčíka vyjadrené pomerom hmotností prvkov je:
m(Mg): m(O)= 3∶2
2.Určte empirický vzorec zlúčeniny obsahujúcej 32,43 % sodíka, 22,55 % síry a 45,02 % kyslíka.
Riešenie:
Z percentuálneho zloženia zlúčeniny logicky vyplýva, že 100 g zlúčeniny obsahuje 32,43 g sodíka, 22,55 g síry a 45,02 g kyslíka. Pre stanovenie pomerov prvkov v zlúčenine potrebujeme poznať pomer látkových množstiev, ktoré vypočítame pomocou vzorca na výpočet mólovej hmotnosti (používame hodnoty mólových hmotností z PSP- periodickej sústavy prvkov):
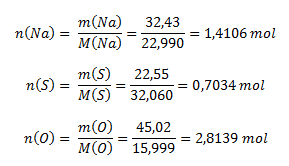
Pomer látkových množstiev prvkov v zlúčenine je:
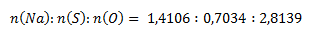
Získané pomery prvkov upravíme na celé čísla tak, že zistené hodnoty predelíme najmenšou z nich:
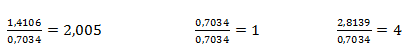
Na jeden mol síry teda pripadajú 4 mol kyslíka a dva moly sodíka. Empirický vzorec zlúčeniny je Na2SO4, síran sodný.
3.Istá zlúčenina obsahuje 2,2 % vodíka, 26,6 % uhlíka a 71,2 % kyslíka. Relatívna molekulová hmotnosť zlúčeniny je 90,034. Zistite molekulový vzorec zlúčeniny.
Riešenie:
Podobne ako v druhom príklade najprv zistíme pomer látkových množstiev prvkov v zlúčenine.
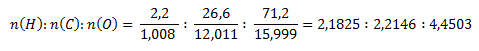
Najmenší pomer látkových množstiev získame predelením hodnotou pre vodík:
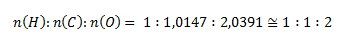
Podľa tohto pomeru je stechiometrický vzorec zlúčeniny HCO2. Relatívna molekulová hmotnosť takejto zlúčeniny by bola 45,017, čo predstavuje presne polovicu zo zadanej hodnoty. Pre získanie zadanej hodnoty 90,034 sa musia prvky nachádzať v zlúčenine dvojnásobne, molekulový vzorec zlúčeniny teda je C2H2O4.
4.Kvalitatívnou analýzou sa dokázalo, že organická kvapalná látka obsahuje uhlík, vodík a kyslík. Orientačné skúšky ukázali, že látka nemá redukčné vlastnosti a univerzálny indikátorový papierik sfarbí na červeno.
Kvantitatívnou analýzou sa stanovilo, že látka obsahuje 39,85 % uhlíka a 6,75 % vodíka. Zistite stechiometrický a molekulový vzorec látky.
5.Látka označená na štítku ako heptahydrát síranu kobaltnatého sa podrobila termickej analýze. Pri termickom rozklade sa zvolila taká teplota, aby zo vzorky unikla všetka voda. Navážilo sa 0,2568 g látky. Po termickom rozklade mal zvyšok hmotnosť 0,1471 g. Aký je skutočný vzorec látky?
Pro zobrazení řešení se přihlaste.
6.Zlúčenina obsahuje uhlík, vodík a kyslík. Jej zloženie je dané pomerom hmotností prvkov:
7.Zistite molekulový vzorec plynnej látky, ktorá má zloženie 92,3 % uhlíka a 7,7 % vodíka. Jeden liter tejto látky má za normálnych podmienok hmotnosť 1,17 g a jeden liter vodíka má za tých istých podmienok hmotnosť 0,09 g.
Pro zobrazení řešení se přihlaste.
8.Železo sa zlučuje s kyslíkom na oxid obsahujúci 77,73 % železa. Vypočítajte látkové množstvá železa a kyslíka v 100g oxidu a ich pomer vyjadrite malými celými číslami.
Pro zobrazení řešení se přihlaste.
9. Určte stechiometrický a molekulový vzorec látky, v ktorej hmotnostný pomer uhlíka, vodíka a kyslíka je
12 : 1 : 32.
Pro zobrazení řešení se přihlaste.
10. Chemickou analýzou látky bolo zistené, že obsahuje 1,5 % vodíka, 56,4 % arzénu a 42,1% kyslíka. Určte stechiometrický vzorec.
Pro zobrazení řešení se přihlaste.