Gleichungen ohne Änderung der Oxidationsstufen
Nicht-Redox-Gleichungen sind Gleichungen chemischer Reaktionen, bei denen sich die Oxidationszahl keines Atoms ändert. Es gibt keinen einfachen und universellen Algorithmus zur Bestimmung der stöchiometrischen Koeffizienten in Nicht-Redox-Reaktionsgleichungen. Chemiker nähern sich der Lösung von Nicht-Redox-Gleichungen zunächst meist durch Versuch und Irrtum, später verbessert durch empirische Methoden, d. h. basierend auf Erfahrung. Die Lösung muss jedoch stets den allgemeinen Regeln zur Berechnung der stöchiometrischen Koeffizienten entsprechen.
- Zu Beginn finden wir in der chemischen Gleichung die Substanz (Reaktant oder Produkt), deren Formel die größten stöchiometrischen Indizes aufweist (d. h. die größte Anzahl von Atomen enthält). Der stöchiometrische Koeffizient dieser Substanz wird als eins betrachtet.
- Dann fügen wir Koeffizienten vor den Substanzen hinzu, die dieselben Atome enthalten wie die Substanz mit dem zugewiesenen Einheitskoeffizienten (nach der Regel des Atomerhaltungsgesetzes oder nach der Regel des Ladungsausgleichs).
- Schrittweise fügen wir Koeffizienten vor Substanzen hinzu, die noch keine Koeffizienten haben, basierend auf der Anzahl der Atome in Substanzen, die bereits Koeffizienten besitzen (wieder nach der Regel des Atomausgleichs oder des Ladungsausgleichs).
- Vorletzter Schritt: Wir bestimmen die Anzahl der Wasserstoffatome und fügen gegebenenfalls stöchiometrische Koeffizienten hinzu.
- Schließlich bestimmen wir die Anzahl der Sauerstoffatome auf beiden Seiten der Gleichung. Diese Operation dient in der Regel zur Überprüfung der bereits erhaltenen Koeffizienten.
1. Gleichen Sie die folgenden chemischen Gleichungen aus:
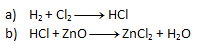
Lösung:
- a) Auf der linken Seite erscheinen sowohl Chlor als auch Wasserstoff zweimal. Nach dem Gesetz der Atomerhaltung muss die gleiche Anzahl auch auf der rechten Seite erscheinen, daher schreiben wir die Zahl 2 vor HCl. Die resultierende Gleichung sieht folgendermaßen aus:
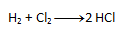
- b) Auf der rechten Seite erscheint Chlor zweimal, aber auf der linken Seite nur einmal. Daher schreiben wir die Zahl 2 vor HCl. Die Anzahl der anderen Elemente „passt“ dann auf beiden Seiten.
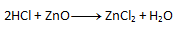
2. Gleichen Sie die folgenden chemischen Gleichungen aus:
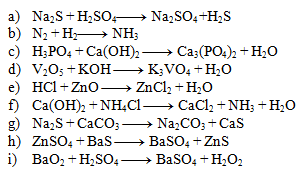
Lösung:
- a) 1,1,1,1
- b) 1,3,2
- c) 2,3,1,6
- d) 1,6,2,3
- e) 2,1,1,1
- f) 1,2,1,2,2
- g) 1,1,1,1
- h) 1,1,1,1
- i) 1,1,1,1
3.
Tragen Sie die stöchiometrischen Koeffizienten in die folgenden Gleichungen ein:
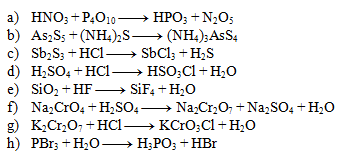
Lösung:
- a) 4,1,4,2
- b) 1,3,2
- c) 1,6,2,3
- d) 1,1,1,1
- e) 1,4,1,2
- f) 2,1,1,1,1
- g) 1,2,2,1
- h) 1,3,1,3
4. Tragen Sie die stöchiometrischen Koeffizienten in die Gleichungen ein:
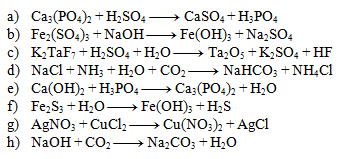
5. Bestimmen Sie die stöchiometrischen Koeffizienten in der Gleichung:
H3PO4 + CaCO3 → Ca3(PO4)2 + CO2 + H2O