Elektrischer Strom in den Elektrolyten
1.Beschreiben Sie den elektrischen Strom in Elektrolyten!
Lösung:
Elektrolyte sind Stoffe, deren Lösungen oder Schmelzen elektrischen Strom mittels Ionen leiten. Elektrischer Strom in Elektrolyten ist eine geordnete Bewegung von Kationen (+) und Anionen (−). Kationen bewegen sich zur Kathode (−), Anionen zur Anode (+). Elektrolytische Dissoziation ist der Prozess, bei dem neutrale Moleküle eines Elektrolyten in Ionen zerfallen. Elektrolyse ist der Prozess, bei dem chemische Veränderungen an den Elektroden und im Elektrolyten auftreten, wenn elektrischer Strom hindurchfließt.
1. Faradaysches Gesetz:
elektrochemisches Äquivalent
2. Faradaysches Gesetz:
Faraday-Konstante
Mm = molare Masse
Oxidationszahl (aus Tabellen)
3. Kombiniertes Faradaysches Gesetz:
Ohmsches Gesetz im Elektrolyten:
Zersetzungsspannung
2.Berechnen Sie:
- a.) die Menge an Aluminium, die sich während der Elektrolyse in 24 Stunden bei einem Strom von 10 kA an der Elektrode abscheidet. A(Al3+) = 0.093·10-6 kg·C-1
- b.) welcher Strom in 1 Stunde Chrom mit einer Masse von 3,24 g aus dem Elektrolyten abscheidet. A(Cr3+) = 0.18·10-6 kg·C-1
Lösung:

- a.) An der Elektrode werden 80 kg Aluminium abgeschieden.
- b.) Chrom wird an der Elektrode von einem Strom von 5 A abgeschieden.
3.Bestimmen Sie das elektrochemische Äquivalent von Aluminium und Kupfer
Lösung:
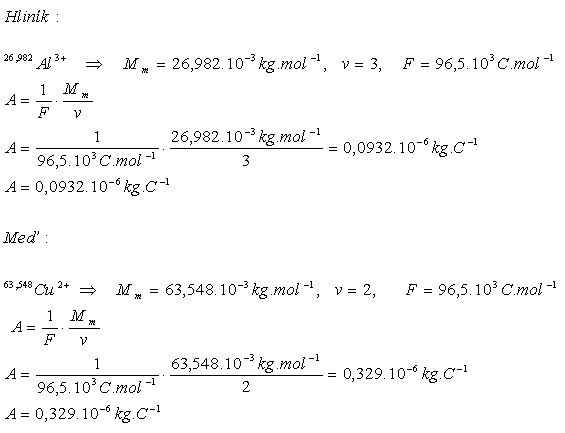
Die elektrochemischen Äquivalente sind A(Al)= 0.0932·10-6 kg·C-1 und A(Cu)=0.329·10-6 kg·C-1
4.Durch einen Elektrolyten aus CuSO4 fließt ein elektrischer Strom von 1 A. Wie viele Kupferatome werden in 10 Sekunden an der Kathode abgeschieden? A(Cu) = 0.329·10-6 kg·C-1, NA = 6.022·1023 mol-1, Mm = 63.548·10-6 kg·mol-1
Bitte melden Sie sich an, um die Lösung anzuzeigen.5.Eine Kugel mit Radius r = 5 cm soll mit einer Schichtdicke h = 0.15 mm vernickelt werden. Wie lange soll die Kugel bei einem Strom I = 1 A im Elektrolyten bleiben?
Bitte melden Sie sich an, um die Lösung anzuzeigen.
6.Das Vernickeln einer Metallplatte mit der Oberfläche 100 cm2 dauerte vier Stunden bei einem Strom von 0.4 A. Berechnen Sie die Dicke der auf der Platte entstandenen Nickelschicht!
Bitte melden Sie sich an, um die Lösung anzuzeigen.7.Wie viel Energie benötigen wir, um 1 g Kupfer durch Elektrolyse von Kupfersulfat CuSO4 zu gewinnen, wenn die Elektrolyse bei einer Spannung von 4 V abläuft?
Bitte melden Sie sich an, um die Lösung anzuzeigen.
8.Zwei Elektrolysezellen mit Lösungen von AgNO3 und CuSO4 sind in Reihe geschaltet. Wie viel Kupfer wird in der Zeit abgeschieden, in der 850 mg Silber abgeschieden werden?
Bitte melden Sie sich an, um die Lösung anzuzeigen.9.Welcher elektrische Strom floss durch den Elektrolyten, wenn die Kupferkathode vor der Messung 35 g und nach der Messung, die 40 Minuten dauerte, 39 g wog?
Bitte melden Sie sich an, um die Lösung anzuzeigen.
10.Die Zersetzungsspannung bei der Elektrolyse von Schwefelsäure betrug 2.2 V. Bei einer Spannung von 3.5 V floss ein Strom von 2.8 A durch den Elektrolyten. Die Elektroden waren 4 cm voneinander entfernt und der Querschnitt des elektrolytischen Leiters betrug 30 cm2. Bestimmen Sie den spezifischen Widerstand des Elektrolyten!
Bitte melden Sie sich an, um die Lösung anzuzeigen.
11.In welcher Zeit wird aus einer CuSO4-Lösung Kupfer mit einer Masse von 1,778 g durch einen Strom von 3 A abgeschieden?
Bitte melden Sie sich an, um die Lösung anzuzeigen.12.Bei der Elektrolyse von Kupfervitriol CuSO4 wird zweiwertiges Kupfer mit einer Masse von m = 9,504 g in 2 Stunden an der Kathode abgeschieden. Das Amperemeter zeigte einen Strom IA = 4,1 A an. Bestimme den Fehler des Amperemeters ΔI.
Bitte melden Sie sich an, um die Lösung anzuzeigen.13.Zwei Elektrolysegefäße mit AgNO3- und CuSO4-Lösungen sind in Reihe geschaltet. Bestimme die Masse des Kupfers, die in der Zeit abgeschieden wird, in der im anderen Gefäß 180 g Silber abgeschieden werden.
Bitte melden Sie sich an, um die Lösung anzuzeigen.14.Bei der Elektrolyse von ZnSO4 wird in 1 Stunde Zink mit der Masse m = 2,45 g abgeschieden. Bestimme den elektrischen Widerstand der Lösung, wenn die Spannung an den Elektroden U = 6 V betrug.
Bitte melden Sie sich an, um die Lösung anzuzeigen.15.Ein Objekt mit einer Oberfläche S = 20 dm2 soll mit einer Schichtdicke h = 0,2 mm versilbert werden. Wie lange wird das Versilbern dauern, wenn 1 dm2 Oberfläche mit einem Strom von I = 0,4 A belastet werden kann?
Bitte melden Sie sich an, um die Lösung anzuzeigen.
16.Wie viel Energie wird benötigt, um bei der Elektrolyse von CuSO4 Kupfer mit der Masse m = 1 g zu erhalten, wenn die Elektrolyse bei einer Spannung U = 4 V durchgeführt wurde?
Bitte melden Sie sich an, um die Lösung anzuzeigen.17.Ein Strom I = 1 A fließt durch eine CuSO4-Lösung. Wie viele Kupferatome werden in t = 1 s an der Kathode abgeschieden? (z = 2)
Bitte melden Sie sich an, um die Lösung anzuzeigen.18.Wie groß ist die elektrische Ladung eines Silberions, das bei der Elektrolyse von Silbernitrat durch eine Ladung Q = 1 C abgeschieden wird?
Bitte melden Sie sich an, um die Lösung anzuzeigen.19.Wie viel a.) Silber b.) zweiwertiges Kupfer wird aus ihren jeweiligen Lösungen abgeschieden, wenn eine Ladung Q = 96,5·106 C hindurchgeht?
Bitte melden Sie sich an, um die Lösung anzuzeigen.
20.Der Akkumulator wurde mit einem Strom I1 = 5 A während einer Zeit t1 = 6 Stunden geladen. Wie lange wurde er entladen, wenn beim Entladen ein konstanter Strom I2 = 0,05 A entnommen wurde? Der Ladewirkungsgrad des Akkumulators beträgt η = 90%.
Bitte melden Sie sich an, um die Lösung anzuzeigen.