Stoffeigenschaften
1.Welche physikalischen Größen charakterisieren einen Stoff?
Lösung:
Atom AZX
-
– Protonenzahl (Anzahl der Protonen im Kern, Anzahl der Elektronen in der Hülle, Ordnungszahl des Elements im Periodensystem nach Mendelejew)
-
– Nukleonenzahl (Anzahl der Protonen und Neutronen im Kern)
-
– Anzahl der Neutronen im Kern
Relative Atommasse
Relative Molekülmasse
Stoffmenge – charakterisiert einen Stoff anhand der Anzahl der darin enthaltenen Teilchen
1 mol – die Einheit der Stoffmenge. Ein Mol ist auch die Stoffmenge, die ebenso viele Teilchen enthält, wie Atome in von .
Avogadro-Konstante:
Molmasse:
Molvolumen:
2.Bestimmen Sie die Ruhemasse der Atome der Elemente H, C, Zn. Wie groß ist die relative Masse von Uran, wenn seine Ruhemasse ma(U) = 3.95·10-25 kg ist. Verwenden Sie Tabellen.
Lösung:
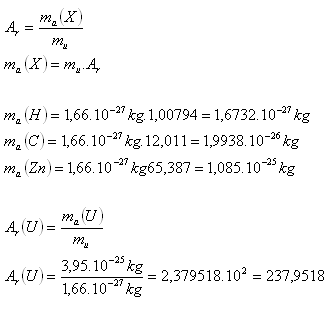
Die relative Masse von Uran ist näherungsweise Ar(U) = 238
3.Schätzen Sie die ungefähre Anzahl der Atome in einem Eisen-Gewicht mit der Masse 1 kg. Wie lang wäre eine Linie, wenn all diese Atome dicht aneinandergereiht in einer einzigen Geraden lägen? Der Durchmesser eines Atoms beträgt etwa 10-10 m.
Lösung:
Analyse:
m = 1 kg, d = 10-10 m, mu = 1.66·10-27 kg, Ar(Fe) = 55.847
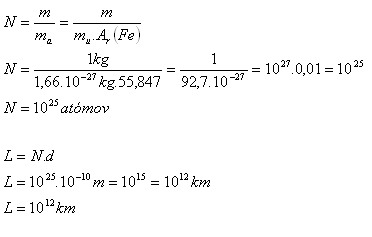
In einem Kilogramm Eisen befinden sich 1025 Atome. Die Länge der von diesen Atomen gebildeten Linie wäre 1012 km. Das ist etwa 6600-mal größer als die Entfernung Erde–Sonne.
4.Bestimmen Sie die Anzahl der in 1 g Kupfer enthaltenen Elektronen. Wie groß ist ihre Gesamtmasse, wenn die Masse eines einzelnen Elektrons 9.1·10-31 kg beträgt?
Bitte melden Sie sich an, um die Lösung anzuzeigen.5.Finden Sie heraus, ob ein Molekül Salpetersäure HNO3 eine größere Masse hat als ein Molekül Silberoxid Ag2O. Verwenden Sie Tabellen.
Bitte melden Sie sich an, um die Lösung anzuzeigen.
6.Berechnen Sie die Stoffmenge, die 4.82·1024 Wasserstoffatomen entspricht.
Bitte melden Sie sich an, um die Lösung anzuzeigen.
7.Bestimmen Sie die Stoffmenge von Wasser mit dem Volumen 3.6 L.
Bitte melden Sie sich an, um die Lösung anzuzeigen.8.Prüfen Sie, ob Wasser mit der Stoffmenge 1 mol in einen Zylinder mit dem Volumen 10 cm3 eingefüllt werden kann.
Bitte melden Sie sich an, um die Lösung anzuzeigen.
9.Ein Raum hat die Abmessungen a = 4 m, b = 4 m, c = 3 m. Wie viele Moleküle Luft befinden sich darin? (Mm = 29·10-3 kg·mol-1, ρ = 1.276 kg·m-3)
Bitte melden Sie sich an, um die Lösung anzuzeigen.
10.Von der Oberfläche eines Wassertropfens mit dem Volumen 1 mm3 verdampft in 1 Sekunde Wasser, das etwa 106 Moleküle enthält. In welcher Zeit verdampft der gesamte Tropfen?
Bitte melden Sie sich an, um die Lösung anzuzeigen.11. Bestimmen Sie die relative Molekülmasse von Kohlendioxid CO2 und die Ruhemasse des CO2-Moleküls. Verwenden Sie Tabellen. (mu = 1.6605·10-27 kg)
Bitte melden Sie sich an, um die Lösung anzuzeigen.
12. Ein geschlossener Behälter im Vakuum enthält gasförmiges Kohlendioxid mit einer Masse von 1.1 kg. Im Durchschnitt entweichen N‘ = 1.5·1020 Moleküle pro Sekunde aus dem Behälter. Nach welcher Zeit werden alle CO2-Moleküle aus dem Behälter entwichen sein?
Bitte melden Sie sich an, um die Lösung anzuzeigen.
13.Berechnen Sie das molare Volumen von Blei.
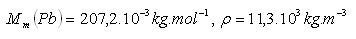
14.Der Durchmesser eines Sauerstoffmoleküls O2 beträgt 0.364 nm. Wie lang wäre die Linie, wenn alle Moleküle, die in einem Mol Sauerstoff enthalten sind, dicht nebeneinander angeordnet würden?
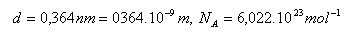
15. Ein Behälter mit einem Volumen von 2 Litern enthält 2.74·1019 Moleküle Chlor Cl2. Berechnen Sie die Moleküldichte NV dieses Gases.
16.Berechnen Sie die quadratische Mittelgeschwindigkeit vk eines Chlormoleküls Cl2 bei einer Temperatur von 100°C.
Bitte melden Sie sich an, um die Lösung anzuzeigen.17.Berechnen Sie die mittlere kinetische Energie eines Moleküls eines idealen Gases bei einer Temperatur t = –20°C. (k = 1.38·10-23 J·K-1)
Bitte melden Sie sich an, um die Lösung anzuzeigen.18.Bestimmen Sie den Durchmesser eines Wassermoleküls H2O.
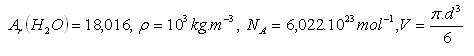
19.Eine Probe von Sauerstoff O2 mit einer Masse von 5 kg hat bei einer Temperatur von 0°C und einem Druck von 0.1 MPa ein Volumen von 3.54 m3. Bestimmen Sie das molare Volumen von Sauerstoff.
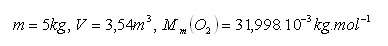
20.Berechnen Sie, wie viele Moleküle im Wasserstoff H2 mit der Stoffmenge n1 = 10 mol und in Ölsäure C17H33COOH mit derselben Stoffmenge n2 = 10 mol enthalten sind.
Bitte melden Sie sich an, um die Lösung anzuzeigen.