Iónové rovnice
Ión je atóm alebo molekula s nenulovým nábojom, teda celkový počet jeho elektónov sa nerovná počtu jeho protónov. Tendencia tvoriť ióny záleží na elektronegativite každého prvku. Ak počet elektrónov prevyšuje počet protónov, atom alebo molekula je záporne nabitá. Takúto časticu nazývame anión. Pokiaľ počet protónov prevyšuje počet elektrónov, častica je nabitá kladne a nazývame ju katión.
Ióny rozlišujeme na monoatómové (Na+, Cl-, Cu2+, Ir3+…), molekulové (OH-, CO32-, HS-…) a komplexné ([Fe(CN)6]4-, [Cu(H2O)6]2+, [Cu(H2O)2(NH3)4]2+, [HgI4]2-…)
Iónové rovnice sú chemické rovnice, ktorými zapisujeme reakcie iónov vo vodných roztokoch kyselín, hydroxidov a solí. Aby mohli tieto reakcie prebiehať, musí byť splnená aspoň jedna podmienka z nasledujúcich:
- Tvorí sa nerozpustná látka- zrazenina
- Tvorí sa slabý elektrolyt
- Tvorí sa plynná látka
- Mení sa oxidačné číslo atómov
Ako celé molekuly zapisujeme slabé elektrolyty (NH4OH, H2S, HCN, H2O…), plyny (CO2, SO2, SO3, NH3, Cl2, NO…) a zrazeniny (AgBr, CaCO3, AgCl, PbI2…).
1. Uvedenú chemickú rovnicu zapíšte v iónovom tvare:
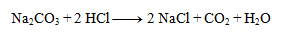
Riešenie:
Na ióny môžeme zapísať len vzorce silných kyselín a zásad a solí dobre rozpustných vo vode. Ostatné látky nerozpisujeme:
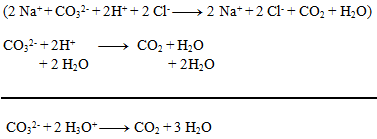
2.Napíšte iónový zápis zrážacej reakcie kyseliny sírovej s chloridom bárnatým.
Riešenie:
Najprv zapíšeme rovnicu v stechiometrickom tvare:
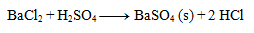
Následne rozpíšeme disociácie:
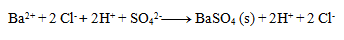
Výsledná rovnica:
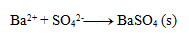
3.Uvedené rovnice sú zápisom zrážacích reakcií. Zapíšte ich v iónovom tvare:
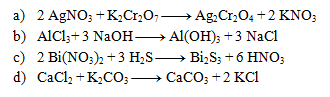
Riešenie:
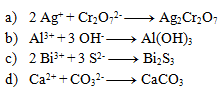
4.Uvedené rovnice sú zápisom komplexotvorných reakcií. Rovnice napíšte v iónovom tvare:
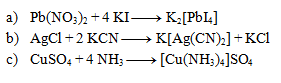
5.Vyčíslite nasledujúce iónové rovnice. Dbajte nielen na súčet atómov prvkov, ale aj na súčet náboja na oboch stranách.
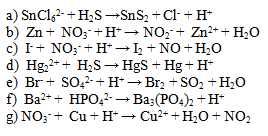
6. Napíšte iónový zápis a skrátený iónový zápis reakcie chloridu sodného s dusičnanom strieborným.
Prihláste sa pre zobrazenie riešenia
7. Zistite stechiometrické koeficienty v nasledujúcej chemickej rovnici:
[SnCl3]– + H2O → [Sn3(OH)4]2+ + H3O+ + Cl–
8. Pôsobením chloridu bárnatého na síran horečnatý vzniká zrazenina síranu bárnatého. Napíšte skrátenú iónovú rovnicu daného chemického procesu.
Prihláste sa pre zobrazenie riešenia
9. Rozpúšťanie zrazeniny fosforečnanu vápenatého pomocou kyseliny dusičnej môžeme zapísať chemickou rovnicou:
Ca3(PO4)2↓ + 6HNO3 → 3Ca(NO3)2 + 2H3PO4
Napíšte iónovú a skrátenú iónovú rovnicu pre tento dej.
10. Zostavte iónovú rovnicu reakcie hydroxidu sodného s kyselinou sírovou.
Prihláste sa pre zobrazenie riešenia
11. Vyčíslite nasledujúce iónové reakcie a dbajte aj na zachovanie celkového náboja reaktantov a produktov, nielen na stechiometriu:
P3- + H2O → PH3 + OH-
Au3+ + Cl- → [AuCl4]-
As2S3 + OH- → AsO2- + AsS2- + H2O
[Cu(H2O)6]2+ + Cl- → [CuCl4]2- + H2O
VO43- + H+ → V3O93- + H2O
CrCl2O2 + OH- → CrO42- + Cl- + H2O
HPO42- + MoO42- + H+ → [P(Mo3O10)4]3- + H2O
[Al(H2O4)(OH)2]+ + CO32- → [Al(H2O)3(OH)3] + HCO3-