Redoxgleichungen
Redoxgleichungen sind chemische Gleichungen von Redoxreaktionen. In Redoxreaktionen ändern sich die Oxidationszahlen der Atome, daher sind Kenntnisse der chemischen Nomenklatur und der Regeln zur Bestimmung von Oxidationszahlen eine wesentliche Voraussetzung für das erfolgreiche Lösen von Redoxgleichungen.
Reduktion ist der Vorgang, bei dem ein Atom seine Oxidationszahl verringert. Oxidation ist der Vorgang, bei dem ein Atom seine Oxidationszahl erhöht. Die Änderung der Oxidationszahl erfolgt durch die tatsächliche oder formale Abgabe von Elektronen (Oxidation) bzw. die Aufnahme von Elektronen (Reduktion; da Elektronen eine negative elektrische Ladung tragen, senkt ihre Aufnahme die Oxidationszahl).
Reduktionsmittel ist ein Reaktant, der die Reduktion eines anderen Reaktanten bewirkt (mindestens ein Atom des Reduktionsmittels erhöht seine Oxidationszahl). Oxidationsmittel ist ein Reaktant, der die Oxidation eines anderen Reaktanten verursacht (mindestens ein Atom des Oxidationsmittels verringert seine Oxidationszahl).
Halbgleichung beschreibt nur die Oxidation oder nur die Reduktion; in der Elektrochemie wird sie auch als Elektrodenreaktion bezeichnet.
Beim Lösen von Redoxgleichungen folgen wir allgemeinen Regeln zur Berechnung stöchiometrischer Koeffizienten nach folgendem Vorgehen:
- Bestimme die Oxidationszahlen aller Atome in der Gleichung.
- Schreibe die Halbgleichung für die Oxidation und die Halbgleichung für die Reduktion.
- Gleiche die Oxidations- und Reduktionshalbgleichungen rechnerisch so an, dass die Elektronenbilanz erfüllt ist.
- Addiere und passe beide Halbgleichungen an, um die vereinfachte Redoxgleichung (SRR) zu erhalten.
- Übertrage die erhaltenen Atomzahlen mithilfe stöchiometrischer Koeffizienten in die chemische Gleichung.
- Ordne gemäß der Atombilanzregel Stoffen, deren Atome ihre Oxidationszahl nicht geändert haben, stöchiometrische Koeffizienten zu.
- Handelt es sich um eine ionische Redoxgleichung, verwende zur Bestimmung stöchiometrischer Koeffizienten die Ladungsbilanz.
Einfache Disproportionierungs- und Komproportionierungs-Redoxreaktionen sind solche chemischen Reaktionen, bei denen sich die Oxidationszahl der Atome nur eines Elements ändert; ansonsten unterscheiden sie sich nicht von anderen Redoxreaktionen.
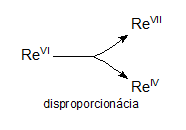
Redoxgleichungen, bei denen die Edukte Atome eines gegebenen Elements mit einer Oxidationszahl enthalten und die Produkte Atome desselben Elements mit unterschiedlichen Oxidationszahlen, nennt man Disproportionierungsgleichungen. Zum Beispiel:
3ReVIF6 + 10H2O → 2HReVIIO4 + ReIVO2 + 18HF
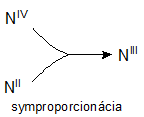
Redoxgleichungen, bei denen die Edukte Atome eines gegebenen Elements mit verschiedenen Oxidationszahlen enthalten und die Produkte Atome desselben Elements nur mit einer Oxidationszahl, nennt man Komproportionierungsgleichungen. Zum Beispiel:
NIVO2 + NIIO + 2NaOH → 2NaNIIIO2 + H2O
1. Gleichen Sie die Redoxgleichung aus:
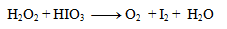
Lösung:
Der erste Schritt besteht darin, die Oxidationszahlen der Atome in jeder Verbindung zu bestimmen:
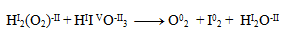
Damit ändern nur Iod und Sauerstoff ihre Oxidationszahlen. Für sie schreiben wir die Halbreaktionen, d. h. Reaktionen, die nur das betreffende oxidierende/reduzierende Element und Elektronen umfassen.
Oxidation:
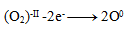
Reduktion:
2IIV +10e- -------> 2I0
Als Nächstes multiplizieren wir die Gleichungen so, dass die Elektronenzahl ausgeglichen ist:
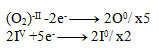
Und dann addieren wir die Gleichungen:
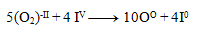
Wir setzen die erhaltenen Koeffizienten in die Ausgangsgleichung ein und berechnen die Anzahl der übrigen Atome, um dem Gesetz der Erhaltung der Atome desselben Elements zu genügen. Die resultierende Gleichung hat die Form:
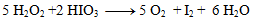
2.Ergänzen Sie die stöchiometrischen Koeffizienten in der Redoxgleichung:
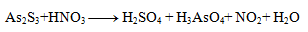
Lösung:
Zunächst sind die Oxidationszahlen der Atome aller Edukte und Produkte zu bestimmen:
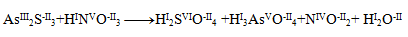
Wir erkennen, dass nur Arsen, Schwefel und Stickstoff ihre Oxidationszahlen ändern. Für diese Elemente schreiben wir Halbreaktionen, in denen wir auch die Zahl der ausgetauschten Elektronen angeben.
Oxidationsgleichungen:
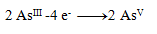
(ein Arsen benötigt 2 Elektronen)
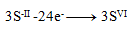
(ein Schwefel benötigt 8 Elektronen)
Reduktionsgleichung:
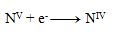
Der nächste Schritt ist, die Zahl der ausgetauschten Elektronen so anzupassen, dass in Oxidationen und Reduktionen dieselbe Anzahl übertragen wird – somit werden in allen drei Halbreaktionen 28 Elektronen ausgetauscht. 24+4=28 Elektronen in der Oxidation, also muss dasselbe in der Reduktion geschehen, daher:
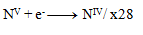
und damit
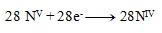
Die stöchiometrischen Koeffizienten aus den Halbreaktionen werden in die Gleichung übernommen und die übrigen Elemente berechnet. Die resultierende Gleichung hat die Form:
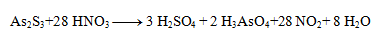
3. Gleichen Sie die folgenden Redoxgleichungen aus:
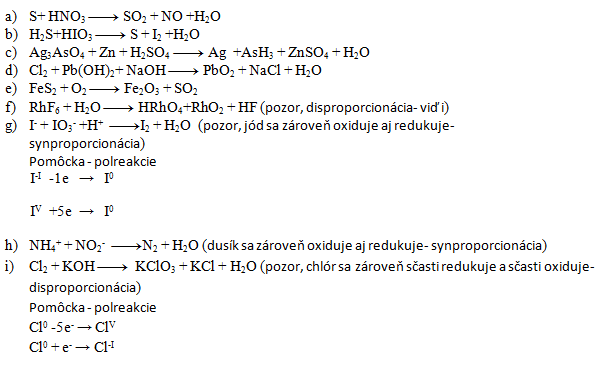
Lösung:
- a) 3,4,3,4,2
- b) 5,2,5,1,6
- c) 2,11,11,6,2,11,8
- d) 1,1,2,1,2,2
- e) 4,11,2,8
- f) 3,10,2,1,18
- g) 5,1,6,3,3
- h) 1,1,1,2
- i) 3,6,1,5,3
4.Bestimmen Sie die stöchiometrischen Koeffizienten in der folgenden chemischen Gleichung:
Cr + H2SO4 → Cr2(SO4)3 + H2
5. Bestimmen Sie die stöchiometrischen Koeffizienten in der folgenden chemischen Gleichung:
Ca3(PO4)2 + SiO2 + C → P4 + CaSiO3 + CO
6.Finden Sie die stöchiometrischen Koeffizienten in der folgenden chemischen Gleichung:
MnO4– + Fe2+ + H3O+ → Mn2+ + Fe3+ + H2O
7. Finden Sie die stöchiometrischen Koeffizienten in der folgenden chemischen Gleichung:
Cu + HNO3 → Cu(NO3)2 + NO2 + H2O
8. Finden Sie die stöchiometrischen Koeffizienten in der folgenden chemischen Gleichung:
KMnO4 + HBr → Br2 + MnBr2 + KBr + H2O
9. Finden Sie die stöchiometrischen Koeffizienten in der folgenden chemischen Gleichung:
ReF6 + H2O → HReO4 + ReO2 + HF
10.Bestimmen Sie die stöchiometrischen Koeffizienten in der folgenden chemischen Gleichung:
MnO42– + H3O+ → MnO4– + MnO2 + H2O
11. Bestimmen Sie die stöchiometrischen Koeffizienten in der folgenden chemischen Gleichung:
NO2 + NO + NaOH → NaNO2 + H2O
12. Finden Sie die stöchiometrischen Koeffizienten in der folgenden chemischen Gleichung:
I– + IO3– + H3O+ → I2 + H2O
13. Finden Sie die stöchiometrischen Koeffizienten in der folgenden chemischen Gleichung (Anspruchsvollere Aufgabe für die Chemie-Olympiade):
FeS2 + O2 → Fe2O3 + SO2
14. Finden Sie die stöchiometrischen Koeffizienten in der folgenden chemischen Gleichung (Anspruchsvollere Aufgabe für die Chemie-Olympiade):
Au + KCN + O2 + H2O → K[Au(CN)2] + KOH