Zustandsgleichung
1. Welche Beziehung besteht zwischen Druck, Volumen und Temperatur eines idealen Gases?
Lösung:
Der Zustand eines idealen Gases im thermodynamischen Gleichgewicht wird durch drei Zustandsgrößen beschrieben: Druck p, Volumen V und thermodynamische Temperatur T. Die wechselseitige Beziehung zwischen diesen Zustandsgrößen wird durch die Zustandsgleichung für ein ideales Gas ausgedrückt.
Zustandsgleichung für ein ideales Gas:
a) Für zwei Zustände (bei konstanter Gasmasse):
b) Für ein Mol:
c) Für n Mol:
d) Für N Moleküle:
e) Für m Kilogramm:
f) Für ein Gemisch chemisch nicht reagierender Gase:
2.Leiten Sie den Zahlenwert und die Dimension der molaren Gaskonstante Rm her.
Lösung:
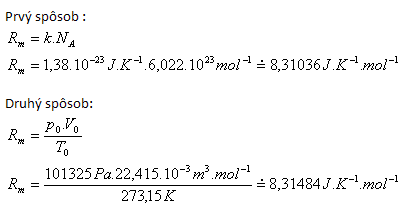
Tabellierter Wert Rm = 3.31441 J·K-1·mol-1.
Abweichungen entstehen durch unterschiedliche Rundungen der Eingabewerte.
3.Ermitteln Sie, wie viele Moleküle in 1 cm3 eines beliebigen Gases unter Normalbedingungen enthalten sind.
Lösung:
Analyse:
V = 1 cm3 = 10-6 m3, p = 101325 Pa, T = 273.15 K
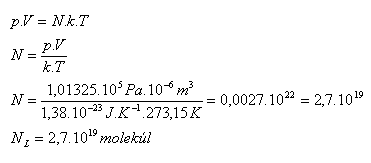
Ein Kubikzentimeter eines beliebigen Gases unter Standardbedingungen enthält NL = 2,7·1019 Moleküle. Dies ist die Loschmidt-Zahl. (Johann Josef Loschmidt 1821–1895)
4. In einem Behälter mit Innenvolumen 8.3 m3 befindet sich Wasserstoff H2 mit der Masse 200 g und der Temperatur 27oC. Bestimmen Sie seinen Druck!
Bitte melden Sie sich an, um die Lösung anzuzeigen.
5.In einem Behälter mit Innenvolumen 5·10-3 m3 befindet sich Stickstoff N2 bei der Temperatur 39oC und dem Druck 1.6·105 Pa. Bestimmen Sie seine Masse.
Bitte melden Sie sich an, um die Lösung anzuzeigen.
6.Wie groß ist der Luftdruck in einem Lkw-Reifen bei einer Temperatur von 20oC und einer Dichte von 8 kg·m-3. Mm(Luft) = 29·10-3 kg·mol-1
Bitte melden Sie sich an, um die Lösung anzuzeigen.7.Wie viele Moleküle befinden sich in einem kugelförmigen Behälter mit dem Innenradius 3 cm, der mit Sauerstoff O2 bei der Temperatur 27oC und dem Druck 1.36·10-2 Pa gefüllt ist?
Bitte melden Sie sich an, um die Lösung anzuzeigen.8.In einem Behälter befindet sich Stickstoff N2 mit der Masse 10 kg bei einem Druck von 10 MPa. Bestimmen Sie die Masse des Stickstoffs, die aus dem Behälter abgelassen werden muss, damit der Druck auf 2.5 MPa sinkt. (Die Temperatur des Stickstoffs ändert sich nicht)
Bitte melden Sie sich an, um die Lösung anzuzeigen.
9.Die Dichte von Stickstoff unter Standardbedingungen (T1 = 273.15 K und p1 = 101325 Pa) beträgt ρ1 = 1.23 kg·m-3. Bestimmen Sie die Dichte von Stickstoff bei 30oC und Normaldruck.
Bitte melden Sie sich an, um die Lösung anzuzeigen.
10. Berechnen Sie die effektive molare Masse der Luft Mm. Betrachten Sie Luft als ein Gemisch aus 75 % Stickstoff und 25 % Sauerstoff.
Bitte melden Sie sich an, um die Lösung anzuzeigen.
11.Ein ideales Gas, das in einem Behälter mit einem inneren Volumen von 2,5 Litern eingeschlossen ist, hat eine Temperatur von -13,150C. Wie groß ist sein Druck, wenn das Gas 1024 Moleküle enthält?
Bitte melden Sie sich an, um die Lösung anzuzeigen.
12.Bestimmen Sie das Volumen von Kohlendioxid CO2 mit einer Masse von 1 Gramm bei einer Temperatur von 210C und einem Druck von 1,0 kPa.
Bitte melden Sie sich an, um die Lösung anzuzeigen.
13.Wie viele Moleküle befinden sich in einem Behälter mit einem Gas, das ein inneres Volumen von 1 Liter hat, wenn das Gas eine Temperatur von 100C und einen Druck von 0.2 MPa aufweist?
Bitte melden Sie sich an, um die Lösung anzuzeigen.
14.Ein ideales Gas, das in einem Behälter eingeschlossen ist, hat ein Volumen von 1,3 m3 und eine Temperatur von -13,150C. Wie groß ist der Druck dieses Gases, wenn seine Stoffmenge 4 Kilomol beträgt?
Bitte melden Sie sich an, um die Lösung anzuzeigen.
15.Bestimmen Sie das Volumen von Sauerstoff O2 mit einer Masse von 8 Gramm bei einer Temperatur von 210C und einem Druck von 1,4·105 Pa.
Bitte melden Sie sich an, um die Lösung anzuzeigen.
16.In einem Behälter mit einem Volumen von 5·10-3 m3 ist Stickstoff N2 bei einer Temperatur von 390C und einem Druck von 1,6·105 Pa eingeschlossen. Bestimmen Sie die Masse des Stickstoffs.
Bitte melden Sie sich an, um die Lösung anzuzeigen.
17.Bestimmen Sie die molare Masse eines Gases, das bei einer Temperatur von 00C und einem Druck von 100 kPa eine Dichte von 1,95 kg·m-3 hat. Um welches Gas handelt es sich?
Bitte melden Sie sich an, um die Lösung anzuzeigen.
18.Die Dichte von Luft unter Normalbedingungen beträgt 1,27 kg·m-3. Bestimmen Sie die Dichte von Luft bei einer Temperatur von 300C und normalem Druck.
Bitte melden Sie sich an, um die Lösung anzuzeigen.
19.Wie ändert sich das Volumen eines idealen Gases, wenn seine thermodynamische Temperatur verdoppelt wird und der Druck um 25 % steigt?
Bitte melden Sie sich an, um die Lösung anzuzeigen.
20.Zeigen Sie, dass jedes ideale Gas unter Normalbedingungen ( p0 = 101325 Pa, T0 = 273.15 K ) dasselbe molare Volumen V0 = 22,4 Liter·mol-1 besitzt.
Bitte melden Sie sich an, um die Lösung anzuzeigen.