Atómový obal
1. Ako vyzerá atóm?
Riešenie:
Aristoteles (384 p.n.l): Hmota je spojitá, dá sa deliť donekonečna. Leukipos , Demokritos (5. stor. p.n.l): Hmota je nespojitá, skladá sa z ďalej nedeliteľných častíc – atómov. J.J.Thomson (1856–1940) vytvoril t.z.v model „hrozienkového koláča“. Atóm je kladne nabitá guľa v ktorej sa vznášajú elektróny. E.Rutherford (1871–1937). Vytvoril „planetárny model atómu“. Celá hmotnosť atómu (tiež jeho kladný náboj) je sústredený v jadre (10–15m). Okolo jadra po kružnici (elipse – A. Sommerfeld) obiehajú elektróny . Polomer atómu je asi 10–10m. Hlavným nedostatkom tohto modelu bolo, že pri obiehaní elektrónu okolo jadra, by elektrón strácal energiu, jeho rýchlosť by sa zmenšovala, pohyboval by sa po špirále a padol by na jadro. Hmotný svet by nemohol existovať. N. Bohr (1883–1962) vytvoril „kvantový model atomu“.
- a.) Elektrón sa môže pohybovať okolo jadra len po celkom určitých kruhových dráhach, ktoré sa volajú orbitály (energetické hladiny) Dĺžka orbitálu sa rovná celočíselnému násobku vlnovej dĺžky de Broglieho vlny, prislúchajúcej elektrónu.
- b.) Ak sa elektrón pohybuje po orbitále, nevyžaruje energiu
- c.) Pri prechode elektrónu z jedného orbitálu na ktorom mal energiu En, na druhý orbitál s menšou energiou Em , vyžiari jedno svetelné kvantum – fotón K. Heisenberg (1901-1976), E. Schrodinger (1887–1961) vytvorili „kvantovo mechanický, pravdepodobnostný model“ Nie je možné rovnako presne určiť polohu elektrónu a súčasne jeho rýchlosť. Dajú sa určiť miesta, kde sa môže elektrón s určitou pravdepodobnosťou v priestore okolo jadra nachádzať
2. Aké vlastnosti má atóm vodíka v Bohrovom modele?
Riešenie:

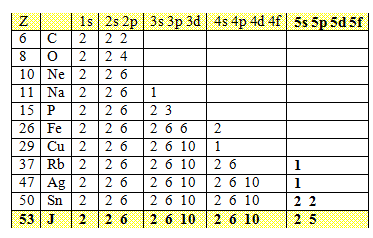
Obsadenie dráh elektrónového obalu niektorých atómov:
3.Za aký čas preletí svetlo atómom s polomerom r = 3.10–10m
Riešenie:
Rozbor:
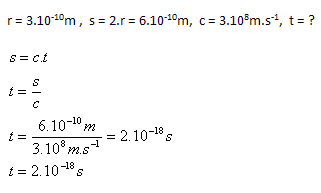
Svetlo preletí atómom za čas t = 2.10–18s.
4. Vypočítajte energiu základného stavu atómu vodíka E1. 1J = 0,6242.1019 eV
Prihláste sa pre zobrazenie riešenia
5.Vypočítajte energie atómu vodíka na stacionárnych dráhach s hlavným kvantovým číslom n = 1,2,3,4,5,6. Energia na prvej kvantovej dráhe je E1 = -13,6 eV. (príklad 4)
Prihláste sa pre zobrazenie riešenia
6.Vypočítajte rýchlosti pohybu elektrónu na jednotlivých orbitáloch v atóme vodíka, ak viete že
r1 = 0,53.10–10m.
Prihláste sa pre zobrazenie riešenia
7.Určite frekvenciu viditeľných čiar Balmerovej série (J.Balmer, 1825-1898) pre vodík. Séria vznikne preskokmi elektrónov na druhú kvantovú dráhu.
Prihláste sa pre zobrazenie riešenia
8.Atóm vodíka, ktorý je v základnom stave, získal energiu 10,2eV. Na ktorú energetickú hladinu pri tom prešiel elektrón?
Prihláste sa pre zobrazenie riešenia
9. Héliovo – neónový laser má výkon 2mW a vysiela žiarenie vlnovej dĺžky 632,8nm. Určite energiu, hmotnosť a hybnosť emitovaných fotónov.
Prihláste sa pre zobrazenie riešenia
10.Atóm vodíka prejde zo stacionárneho stavu n = 6 do stavu m = 1 Vypočítajte frekvenciu a vlnovú dĺžku vyžiareného fotónu. Použite Rydbergov zákon. (J.R. Rydberg 1854-1919)
Prihláste sa pre zobrazenie riešenia
11.Vypočítajte veľkosť elektromagnetickej energie, ktorú vyžiari atóm vodíka, ak jeho elektrón preskočí z prvého orbitálu na nekonečne vzdialený orbitál.
Prihláste sa pre zobrazenie riešenia
12.Odvoďte Rydbergovu konštantu R
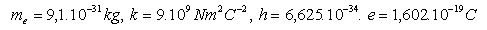
13.Určite tri najdlhšie vlnové dĺžky Balmerovej série. Táto séria zodpovedá vyžarovaniu energie elektrónu pri prechode 3 – 2, 4 – 2, 5 – 2.
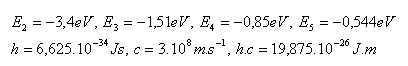
14.Aké napätie musí byť v elektrickom poli, ak v ňom máme urýchliťelektrón tak, aby mohol pri zrážke s atómom vodíka previesť atóm zo základného stavu do prvého excitovaného stavu.
Prihláste sa pre zobrazenie riešenia
15.Polomer prvej kružnicovej dráhy elektrónu v atóme vodíka je r = 0,53.10–10m. Určite intenzitu elektrického poľa od jadra na tejto dráhe.
Prihláste sa pre zobrazenie riešenia
16.Aký veľký je potenciál jadra atómu na prvej dráhe elektrónu v atóme vodíka?
(E = 51,3.1010N.C–1 – príklad 15)
Prihláste sa pre zobrazenie riešenia17.Zistite, či môže nastať fotoelektrický jav pri dopade viditeľného svetla na zinok WV(Zn) = 4eV. Najkratšia vlnová dĺžka viditeľného svetla je λ = 390nm.
Prihláste sa pre zobrazenie riešenia
18.Výstupná práca z platiny je WV(Pt) = 5,29eV. Vypočítajte medzný kmitočet f0, pri ktorom nastane fotoelektrický jav.
Prihláste sa pre zobrazenie riešenia
19.Akou rýchlosťou vystupujú elektróny z povrchu cézia, ak jeho povrch osvetlíme monochromatickým svetlom s vlnovou dĺžkou λ = 590nm. Výstupná práca cézia je WV(Cs) = 1,93eV
Prihláste sa pre zobrazenie riešenia
20.Odvoďte vzťah pre výpočet energie elektrónu, ktorý je viazaný na úsečku dĺžky L.
Prihláste sa pre zobrazenie riešenia
21.Aká bude energia základného a prvého excitovaného stavu elektrónu viazaného na úsečku L = 4.10–10m
Prihláste sa pre zobrazenie riešenia
22.Akú dĺžku musí mať úsečka, na ktorú je viazaný elektrón, aby rozdiel energií základného a prvého excitovaného stavu bol menší ako 3 eV.
Prihláste sa pre zobrazenie riešenia
23.Akú elektrónovú konfiguráciu má atóm sodíka, železa, medi a striebra? Použite tabuľku v príklade č. 2.
Prihláste sa pre zobrazenie riešenia
24. Ktoré prvky majú dané konfigurácie:
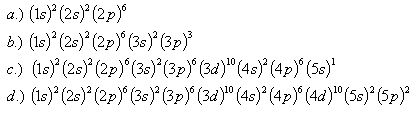
25.Určite energiu elektrónu v základnom stave molekuly butadiénu s konfiguráciou (1s)2(2s)2. Elektróny sa pohybujú po celej dĺžke L = 0,6.10–9m molekuly.
Prihláste sa pre zobrazenie riešenia