Izodejě
1. Co jsou izodejě?
Řešení:
Izodejě jsou děje v ideálním plynu se stálou hmotností, při kterých je některá stavová veličina stálá.

2.Jak velký objem bude mít 30 litrů vzduchu, pokud při téže teplotě zvýšíme jeho tlak ze 72 kPa na 75 kPa?
Řešení:
Rozbor:
V1 = 30l = 30.10-3m3, p1 = 72.103Pa, p2 = 75.103Pa, V2 = ?
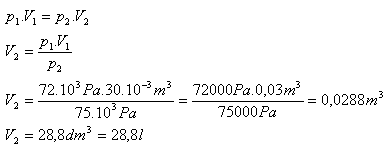
Po zvýšení tlaku bude mít vzduch objem 28,8 litru.
3.Hustota hélia při tlaku 105Pa je ρ1 = 0,164 kg.m-3. Jaká bude jeho hustota, pokud jej stiskneme tlakem 5.107Pa. (Hmotnost a teplota plynu se stisknutím nemění).
Řešení:
Rozbor:
p1 = 105 Pa, ρ1 = 0,164 kg.m-3 , p2 = 5.107Pa, ρ2 = ?
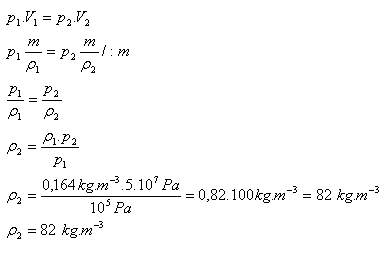
Hustota helia po stisknutí bude ρ = 82 kg.m-3
4.Hustota vzduchu za normálních podmínek je ρ1 = 1,3 kg.m-3. Jaká bude hustota vzduchu, pokud jej za normálních podmínek ohřejeme na 30oC. (Množství vzduchu se nemění).
Řešení:
Rozbor:
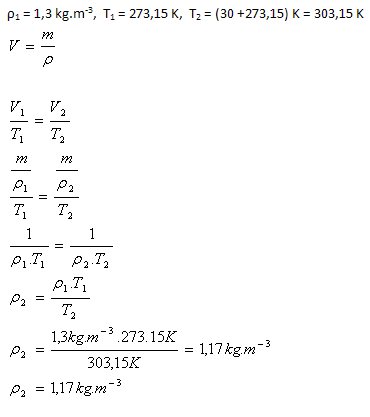
Hustota vzduchu bude 1,17 kg.m-3
5.Plyn uzavřený v nádobě s pohyblivým pístem se při stálém tlaku zahřál z 22oC na teplotu 49oC.
O kolik% se zvětšil jeho objem?
Řešení:
Rozbor:
T1 = 295,15 K, T2 = 322,15 K, p%=?
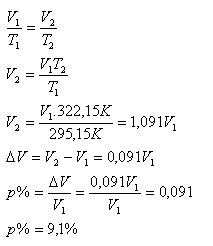
Objem plynu po zahřátí se zvětšil o 9,1%
6. Žárovka se při výrobě plní dusíkem pod tlakem 50,6 kPa a teplotě 18oC. Jakou teplotu má dusík v rozsvícené žárovce, pokud se jeho tlak zvětší na 118 kPa.
Řešení:
Rozbor:
p1 = 50,6 kPa = 50,6.103Pa, T1 = 291,15 K, p2 = 118 kPa = 118.103Pa, T2 =?
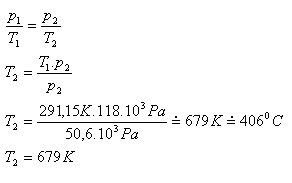
Teplota dusíku v rozsvícené žárovce je asi 679 K.
7.Při závodech Formule 1 se teplota vzduchu v pneumatikách zvýšila ze 19oC na 79oC. Jak se změní tlak v pneumatice, když byla původně nahuštěna na 240 kPa. Proč je před ostrým startem zařazeny "zahřívací kolo"? (Vnitřní objem pneumatiky se nemění)
Řešení:
Rozbor:
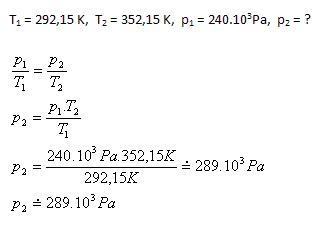
Tlak vzduchu v pneumatice po zahřátí se zvýší na asi 289 kPa. Zahřívací kolo zajišťuje, aby přímo při závodech nedošlo k prudkému zvýšení tlaku vzduchu v pneumatikách a tím i zvýšení teploty pneumatik.
8.V kruhovém válci je vzduch uzavřený pohyblivým pístem umístěným ve vzdálenosti 50 cm od dna válce. Vzduch má tlak 105 Pa. Pokud píst při adiabatické kompresi posuneme o 20 cm ke dnu, tlak vzduchu se zvětší na 2,05.105 Pa. Určetě Poissonovo konstantu vzduchu!
Řešení:
Rozbor:
h1 = 0,5 m, V1 = 0,5S, h2 = 0,3 m, V2 = 0,3S, p1 = 105Pa,
p2 = 0,05.105Pa, κ = ?
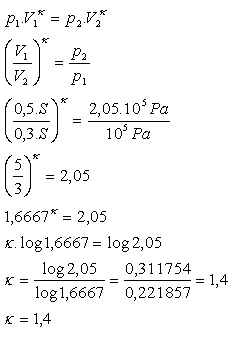
Poissonova konstanta pro vzduch je κ = 1,4
9.Ukažte, že pro adiabatický děj platí T1.V1κ-1 = T2.V2κ-1
Řešení:
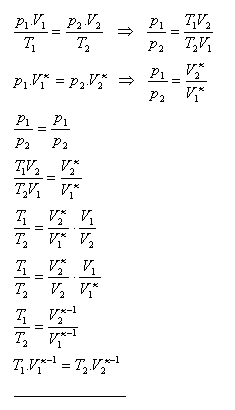
10.Při adiabatické kompresi vzduchu se jeho objem snížil na 1/10 původního objemu. Vypočtěte tlak a teplotu vzduchu po skončení adiabatické komprese. Počáteční tlak vzduchu byl 105P, počáteční teplota 20oC. κ(vzduch) = 1,4
Řešení:
Rozbor:
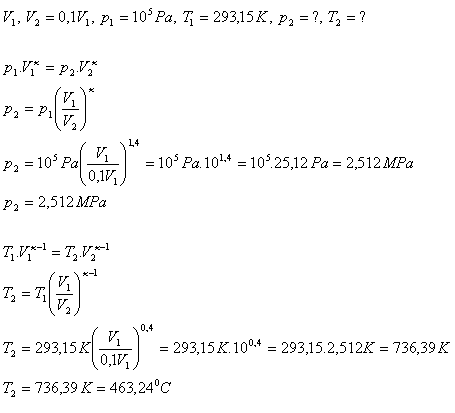
Po adiabatické kompresi se tlak vzduchu zvýšil na 2,512 MPa, teplota na 463,24oC.
11.Tlak plynu v uzavřené nádobě při teplotě 110C je 189 kPa. Jaká bude teplota tohoto plynu, jestliže se jeho tlak zvýší na 1 MPa?
Řešení:
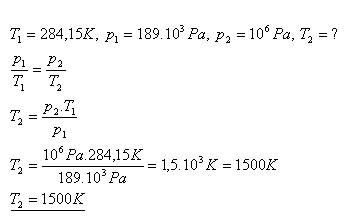
Teplota plynu se zvýší na 1500 K.
12.Tlak plynu při teplotě 200C je 107 kPa. Jaký bude jeho tlak, pokud se jeho teplota zvýší na 1500C?
Řešení:
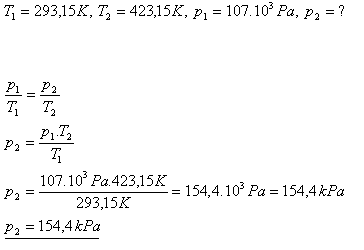
Tlak plynu sa zvýší na 154,4 kPa.
13.Teplota kyslíku s danou hmotností se zvyšuje isobarickými z počáteční teploty-200C. Při jaké teplotě má kyslík 1,5 krát větší objem než při počáteční teplotě.
Řešení:
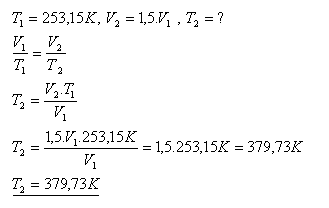
Kyslík má 1,5 krát větší objem při teplotě 379,73 K (čo je 106,580C)
14.Jaký děj je zapsán v tabulce:
15.Objem plynu 25 litrů má tlak 1 kPa. Jaký bude jeho tlak, jestliže zmenšíme jeho objem na 20% původního objemu?
Řešení:
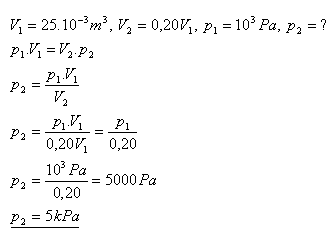
Tlak plynu sa zvýší na 5 kPa.
16.Nádoba tvaru válce dlouhá 30 cm je uzavřena pohyblivým pístem. V nádobě je uzavřen plyn při tlaku 0,5 MPa. Určitě jeho tlak, pokud se zvětší vnitřní objem nádoby posunutím pístu o 10 cm.
Řešení:
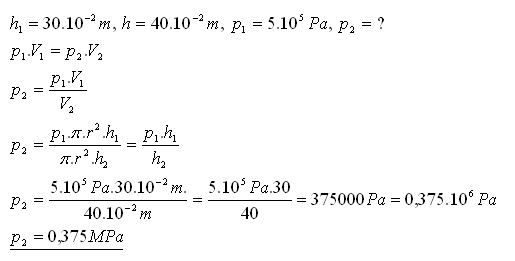
Tlak plynu sa zmenší na 0,375 MPa.
17. Střední volná dráha molekuly 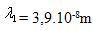 je při tlaku p1 = 105P. Jaká bude střední volná dráha molekuly při tlaku:
je při tlaku p1 = 105P. Jaká bude střední volná dráha molekuly při tlaku:
Řešení:
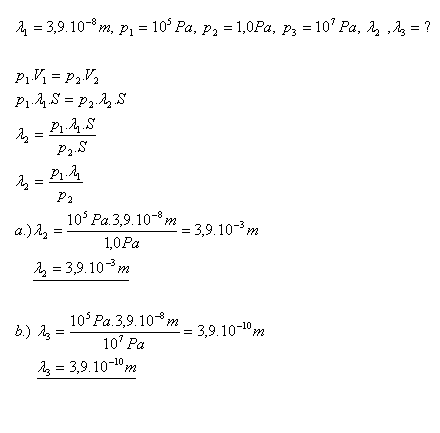
18.Vodík H2 má teplotu-30C. Adiabatické expanzí se jeho objem zvětší na trojnásobek původního objemu. Jaká je výsledná teplota vodíku při tomto adiabatickém ději?
Řešení:
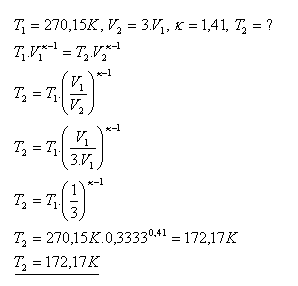
Výslední teplota vodíka je 172,17 K.(t = -100,980C).
19.Argon má při normálním tlaku p1 = 101325 Pa objem V1 = 10 litrů. Po adiabatické kompresi se jeho objem změní na V2 = 4 litry a tlak na p2 = 0,468 MPa. Určete Poissonovu konstantu pre argon.
Řešení:
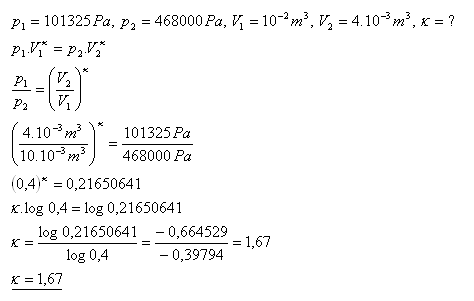
Poissonova konstanta pre argon je 1,67.
20.Určetě měrnou tepelnou kapacitu argonu při stálém objemu cV, pokud měrná tepelná kapacita argonu při stálém tlaku je:
cP = 525 J.kg-1.K-1.
Řešení:
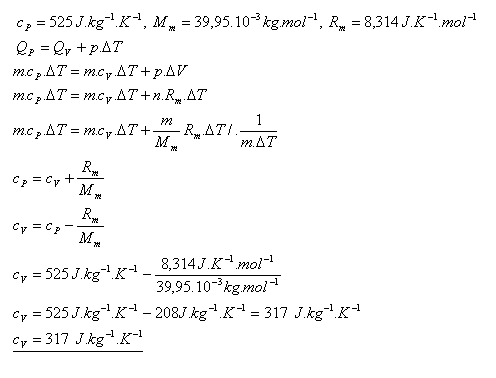
Měrná tepelná kapacita argonu při stálém objemu je cV = 317 J.kg-1.K-1.