Izodeje
1. Čo sú izodeje?
Riešenie:
Izodeje sú deje v ideálnom plyne so stálou hmotnosťou, pri ktorých je niektorá stavová veličina stála.

2.Aký veľký objem bude mať 30 litrov vzduchu, ak pri tej istej teplote zvýšime jeho tlak zo 72 kPa na 75 kPa?
Riešenie:
Rozbor:
V1 = 30l = 30.10-3m3, p1 = 72.103Pa, p2 = 75.103Pa, V2 = ?
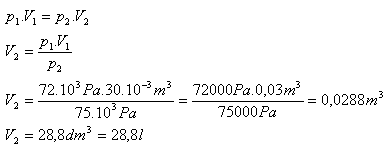
Po zvýšení tlaku bude mať vzduch objem 28,8 litra.
3.Hustota hélia pri tlaku 105Pa je ρ1 = 0,164 kg.m-3. Aká bude jeho hustota, ak ho stlačíme tlakom 5.107Pa. (Hmotnosť a teplota plynu sa stlačením nemenia).
Riešenie:
Rozbor:
p1 = 105 Pa, ρ1 = 0,164 kg.m-3 , p2 = 5.107Pa, ρ2 = ?
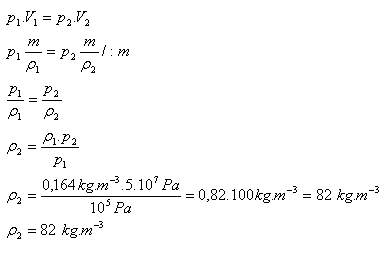
Hustota hélia po stlačení bude ρ = 82 kg.m-3
4.Hustota vzduchu za normálnych podmienok je ρ1 = 1,3 kg.m-3. Aká bude hustota vzduchu, ak ho za normálnych podmienok ohrejeme na 30oC. (Množstvo vzduchu sa nemení).
Riešenie:
Rozbor:
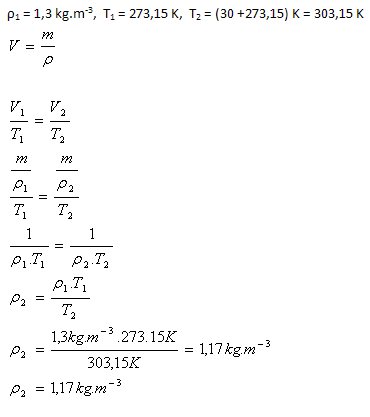
Hustota vzduchu bude 1,17 kg.m-3
5.Plyn uzavretý v nádobe s pohyblivým piestom sa pri stálom tlaku zohrial z 22oC na teplotu 49oC. O koľko % sa zväčšil jeho objem?
Riešenie:
Rozbor:
T1 = 295,15 K, T2 = 322,15 K, p%=?
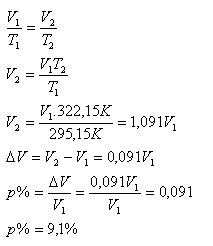
Objem plynu po zohriatí sa zväčšil o 9,1%
6. Žiarovka sa pri výrobe plní dusíkom pod tlakom 50,6 kPa a teplote 18oC. Akú teplotu má dusík v rozsvietenej žiarovke, ak sa jeho tlak zväčší na 118 kPa.
Riešenie:
Rozbor:
p1 = 50,6 kPa = 50,6.103Pa, T1 = 291,15 K, p2 = 118 kPa = 118.103Pa, T2 =?
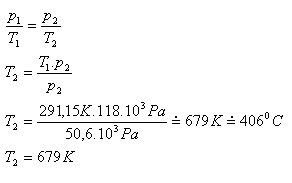
Teplota dusíka v rozsvietenej žiarovke je asi 679 K.
7.Pri závodoch Formuly 1 sa teplota vzduchu v pneumatikách zvýšila zo 19oC na 79oC. Ako sa zmení tlak v pneumatike, keď bola pôvodne nahustená na 240 kPa. Prečo je pred ostrým štartom zaradené „zahrievacie kolo“? (Vnútorný objem pneumatiky sa nemení)
Riešenie:
Rozbor:
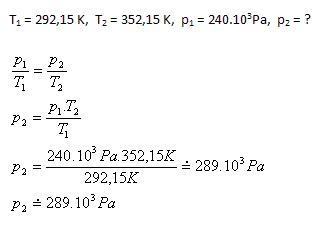
Tlak vzduchu v pneumatike po zohriatí sa zvýši na asi 289 kPa. Zahrievacie kolo zabezpečuje, aby priamo pri pretekoch nedošlo k prudkému zvýšeniu tlaku vzduchu v pneumatikách a tým aj zvýšeniu teploty pneumatík.
8.V kruhovom valci je vzduch uzavretý pohyblivým piestom umiestneným vo vzdialenosti 50 cm od dna valca. Vzduch má tlak 105 Pa. Ak piest pri adiabatickej kompresii posunieme o 20 cm ku dnu, tlak vzduchu sa zväčší na 2,05.105Pa. Určite Poissonovu konštantu vzduchu!
Riešenie:
Rozbor:
h1 = 0,5 m, V1 = 0,5S, h2 = 0,3 m, V2 = 0,3S, p1 = 105Pa,
p2 = 0,05.105Pa, κ = ?
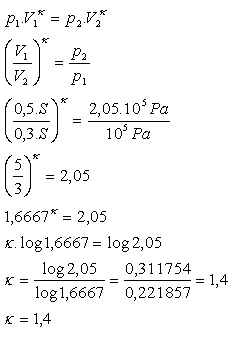
Poissonova konštanta pre vzduch je κ = 1,4
9.Ukážte, že pre adiabatický dej platí T1.V1κ-1 = T2.V2κ-1
Riešenie:
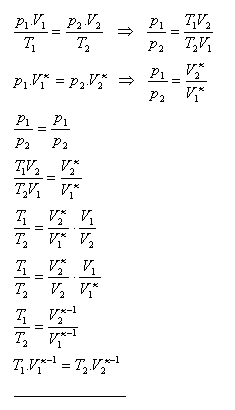
10. Pri adiabatickej kompresii vzduchu sa jeho objem zmenšil na 1/10 pôvodného objemu. Vypočítajte tlak a teplotu vzduchu po skončení adiabatickej kompresie. Začiatočný tlak vzduchu bol 105Pa, začiatočná teplota 20oC. κ(vzduch) = 1,4
Riešenie:
Rozbor:
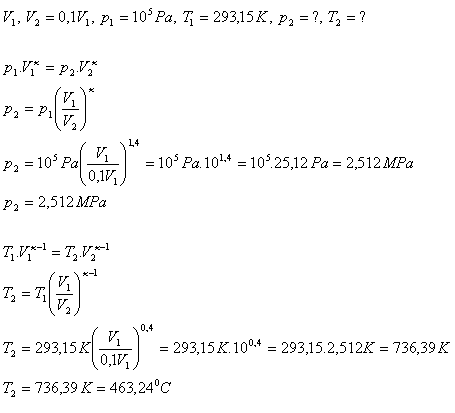
Po adiabatickej kompresii sa tlak vzduchu zvýšil na 2,512 MPa, teplota na 463,24oC.
11.Tlak plynu v uzavretej nádobe pri teplote 110C je 189 kPa. Aká bude teplota tohto plynu, ak sa jeho tlak zvýši na 1 MPa ?
Riešenie:
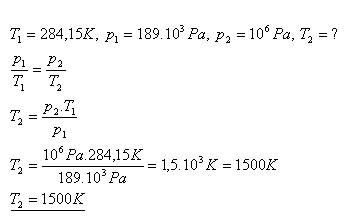
Teplota plynu sa zvýši na 1500 K.
12.Tlak plynu pri teplote 200C je 107 kPa. Aký bude jeho tlak, ak sa jeho teplota zvýši na 1500C ?
Riešenie:
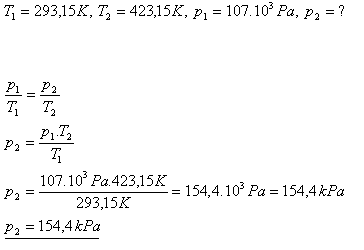
Tlak plynu sa zvýši na 154,4 kPa.
13.Teplota kyslíka s danou hmotnosťou sa zvyšuje izobaricky zo začiatočnej teploty -200C. Pri akej teplote má kyslík 1,5 krát väčší objem ako pri začiatočnej teplote.
Riešenie:
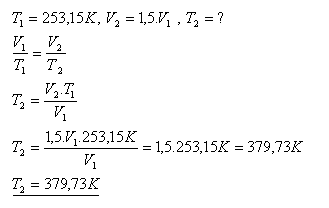
Kyslík má 1,5 krát väčší objem pri teplote 379,73 K (čo je 106,580C)
14.Aký dej je zapísaný v tabuľke:
15.Objem plynu 25 litrov má tlak 1 kPa. Aký bude jeho tlak, ak zmenšíme jeho objem na 20% z pôvodného objemu ?
Riešenie:
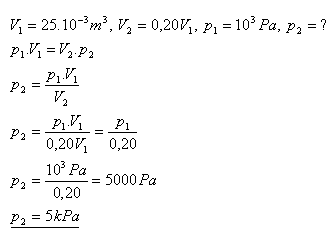
Tlak plynu sa zvýši na 5 kPa.
16.Nádoba tvaru valca dlhá 30 cm je uzavretá pohyblivým piestom. V nádobe je uzavretý plyn pri tlaku 0,5 MPa. Určite jeho tlak, ak sa zväčší vnútorný objem nádoby posunutím piesta o 10 cm.
Riešenie:
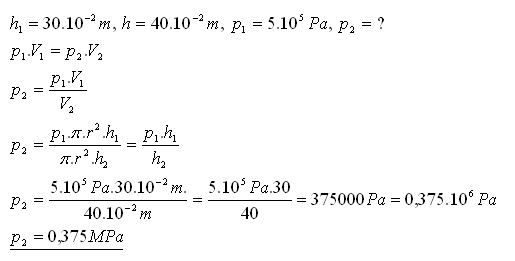
Tlak plynu sa zmenší na 0,375 MPa.
17. Stredná voľná dráha molekuly 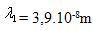 je pri tlaku p1 = 105Pa. Aká bude stredná voľná dráha molekuly pri tlaku
je pri tlaku p1 = 105Pa. Aká bude stredná voľná dráha molekuly pri tlaku
Riešenie:
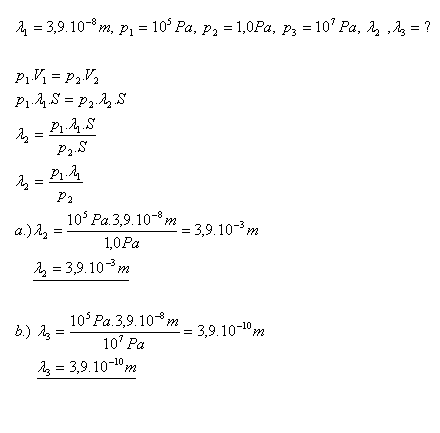
18.Vodík H2 má teplotu -30C. Adiabatickou expanziou sa jeho objem zväčší na trojnásobok pôvodného objemu. Aká je výsledná teplota vodíka pri tomto adiabatickom deji?
Riešenie:
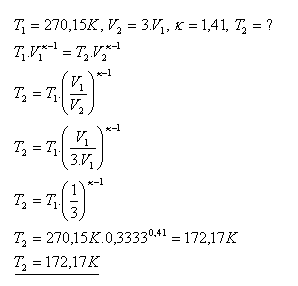
Výsledná teplota vodíka je 172,17 K.(t = -100,980C).
19.Argón má pri normálnom tlaku p1 = 101325 Pa objem V1 = 10 litrov. Po adiabatickej kompresii sa jeho objem zmení na V2 = 4 litre a tlak na p2 = 0,468 MPa. Určite Poissonovu konštantu pre argón.
Riešenie:
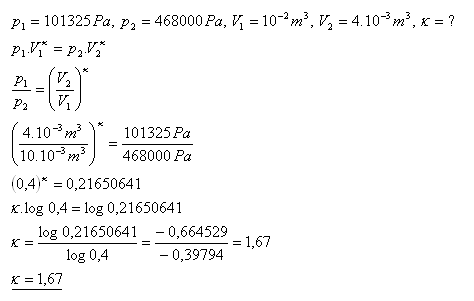
Poissonova konštanta pre argón je 1,67.
20.Určite mernú tepelnú kapacitu argónu pri stálom objeme cV, ak merná tepelná kapacita argónu pri stálom tlaku je
cP = 525 J.kg-1.K-1.
Riešenie:
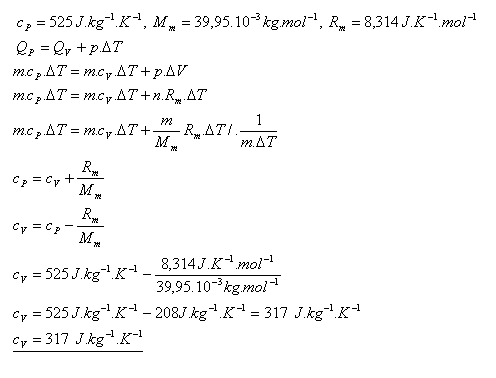
Merná tepelná kapacita argónu pri stálom objeme je cV = 317 J.kg-1.K-1.