Zloženie roztokov
1. Koľko gramov dusičnanu vápenatého a vody je v 130 g 20% roztoku?
Riešenie:
100 gramov roztoku...........20 g dusičnanu
130 g.........................................x g dusičnanu
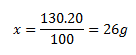
Hmotnosť vody dopočítame 130-26= 104 g vody. Roztok je zložený z 26 gramov dusičnanu a 104 gramov vody.
2.V 100 ml vody bolo rozpustených 30 g modrej skalice (pentahydrát síranu meďnatého). Aká je hmotnostná koncentrácia takto pripraveného roztoku?
Riešenie:
Najprv je potrebné vypočítať množstvo čistého síranu v modrej skalici.
M(CuSO4.5H20)= 249,68 g·mol-1
M(CuSO4)= 159,60 g·mol-1
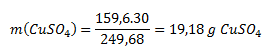
Hmotnosť roztoku je 100g (voda)+ 30g(skalica)= 130 g. Koncentrácia roztoku teda je:
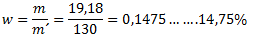
3. Koľko gramov hydroxidu sodného treba na prípravu 5 litrov 10% roztoku s hustotou ρ =1115 kg.m-3?
Riešenie:
Využijeme kombináciu vzorca na výpočet hmotnostnej koncentrácie a hustoty:
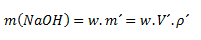
kde m´ je hmotnosť roztoku, V´ je objem roztoku a ρ´ je hustota roztoku.
Po dosadení číselných hodnôt:
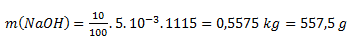
Na prípravu 5 litrov 10% roztoku potrebujeme 557,5 g NaOH.
4. Vypočítajte molárnu koncentráciu 22% kyseliny sírovej s hustotou 1,1548 g.cm-3.
Riešenie:
Z hustoty vyplýva, že 1 liter tohto roztoku váži 1154,8 g. V tomto roztoku sa však nachádza len 22% čistej kyseliny, preto jej hmotnosť vypočítame nasledovne:
m(čistej kyseliny) = 1154,8 . 0,22 = 254,848 g
Mólová hmotnosť kyseliny sírovej je 98 g.mol-1.
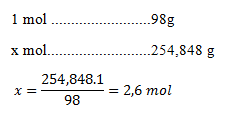
V jednom litri roztoku sa nachádza 2,6 mol kyseliny, koncentrácia teda je 2,6 mol.dm-3.
5. Vodný roztok etanolu obsahuje 90 ml čistého liehu v 150 ml roztoku. Aké je objemové a hmotnostné percento roztoku?
Riešenie:
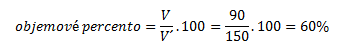
Na výpočet hmotnostného percenta potrebujeme hustoty etanolu a roztoku- tie zistíme z chemických tabuliek:
ρ100% = 0,7893 g·cm–3
ρ60% = 0,9094 g·cm–3
z týchto hodnôt vypočítame hmotnosti takýchto roztokov:
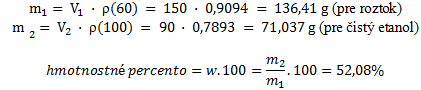
Zloženie roztoku je 60% (v/v), resp. 52,08% (w/v).
6. Koľko g chloridu draselného a koľko ml vody potrebujeme na prípravu 245 g 2,5% roztoku?
Riešenie:
Použijeme upravený vzťah pre výpočet hmotnostnej koncentrácie:
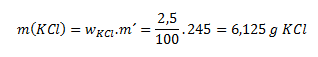
Množstvo vody vypočítame ako 245g (roztok) – 6,125 g (chlorid)=238,875g vody.
Na prípravu roztoku potrebujeme 6,125 gramov chloridu draselného a 238,875 g vody, čo podľa jednotkovej hustoty vody zodpovedá 238,875 ml vody.
7. Aká hmotnosť manganistanu draselného sa nachádza v 25 ml 0,02 molárneho roztoku?
M(KMnO4)= 158,342 g.mol-1.
Riešenie:
Využijeme upravený vzťah pre látkovú koncentráciu:
m=c.M.V=0,02 .158,342 .0,025=0,0792g
Hmotnosť manganistanu je 0,0792g.
8.Akú látkovú koncentráciu bude mať roztok síranu amónno-železitého, ak 1 ml takéhoto roztoku zodpovedá 1 mg Fe2O3? M(Fe2O3)=159,7 g.mol-1.
Riešenie:
Ak 1 ml roztoku NH4Fe(SO4)2 zodpovedá 1 mg Fe2O3, potom 1000 ml tohoto roztoku zodpovedá 1 g Fe2O3. Látková koncentácia oxidu bude:
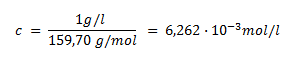
Pretože 1 mol Fe2O3 ≈ 2 mol NH4Fe(SO4)2, bude roztok síranu amónno-železitého 0,012524 molárny
(dvakrát koncentrovanejší než Fe2O3) .
9. Aký je hmotnostný zlomok a percentuálne zloženie roztoku, ktorý obsahuje v 10 ml vody 1,02 rozpustenej látky?
Riešenie:
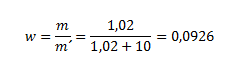
hmotnostné percento=w.100=0,0926.100=9,26%
Hmotnostný zlomok rozpustenej látky je 0,0926, hmotnostné percento je 9,26%.
10. Aká je látková a hmotnostná koncentrácia roztoku kyseliny dusičnej, ktorého hmotnostné percento je 40? ρ40 = 1,252 g·cm-3, Mr(HNO3) = 63,01.
Riešenie:
Hmotnosť HNO3 v 1 litri vypočítame ako:
m= 0,40 . 1252 = 500,8 g
Hmotnostná koncentrácia:
δ = 500,8 / 1 = 500,8 g.l-1
Látková koncentrácia:
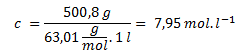
Hmotnostná koncentrácia je 500,8 g·l-1, látková je 7,95 mol·l-1.