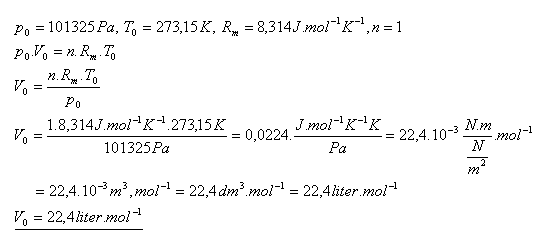Stavová rovnica
1. Aký je vzťah medzi tlakom, objemom a teplotou ideálneho plynu?
Riešenie:
Stav ideálneho plynu, ktorý je v termodynamickej rovnováhe opisujú tri stavové veličiny: tlak p, objem V a termodynamická teplota T. Vzájomný vzťah medzi týmito stavovými veličinami vyjadruje stavová rovnica ideálneho plynu.
Stavová rovnica ideálneho plynu:
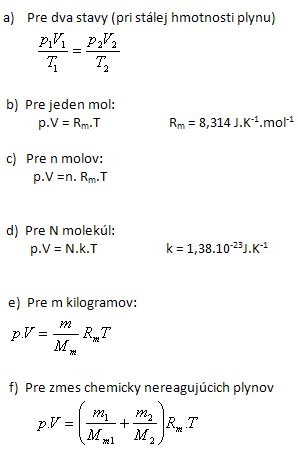
2.Odvoďte číselnú hodnotu a rozmer molovej plynovej konštanty Rm.
Riešenie:
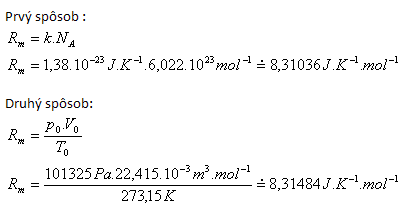
Tabuľková hodnota Rm = 3,31441J.K-1.mol-1.
Rozdiely sú spôsobené rôznym zaokrúhľovaním vstupných hodnôt.
3.Zistite koľko molekúl obsahuje 1 cm3 ľubovoľného plynu za normálnych podmienok.
Riešenie:
Rozbor:
V = 1 cm3 = 10-6m3, p = 101325 Pa, T = 273,15 K
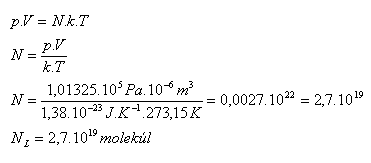
Jeden cm3 ľubovoľného plynu za normálnych podmienok obsahuje NL = 2,7.1019molekúl. Je to Loschmidtovo číslo. (Jozef Loschmidt 1821–1895)
4. V nádobe s vnútorným objemom 8,3 m3 je vodík H2 s hmotnosťou 200 g a teplotou 27oC. Určite jeho tlak!
Riešenie:
Rozbor:
V = 8,3 m3, m = 200 g = 0,2 kg, t = 27oC, T = (27 +273,15) K= 300,15 K
Mm = 2.1.10-3kg.mol-1, Rm = 8,314 J.K-1.mol-1
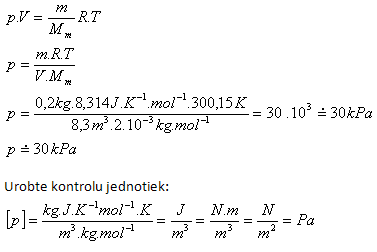
V nádobe je tlak vodíka asi 30 kPa.
5.V nádobe s vnútorným objemom 5.10-3m3 je uzavretý dusík N2 pri teplote 39oC a tlaku 1,6.105Pa. Určite jeho hmotnosť.
Riešenie:
Rozbor:
V = 5.10-3m3, p =1,6.105Pa, T = 312,15 K, Rm = 8,314 J.K-1.mol-1
Mm = 2.14.10-3kg.mol-1
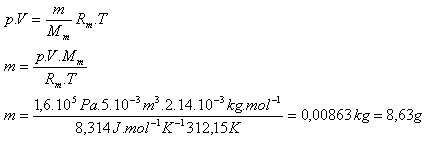
Hmotnosť dusíka je m = 8,63 g
6.Aký tlak má vzduch v pneumatike nákladného auta pri teplote 20oC a hustote 8kg.m-3. Mm(vzduch) = 29.10-3kg.mol-1
Riešenie:
Rozbor:
T = 293,15 K, ρ = 8kg.m-3, Mm(vzduch) = 29.10-3kg.mol-1
Rm = 8,314 J.K-1.mol-1
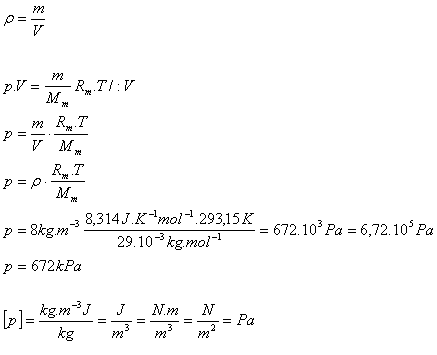
Tlak vzduchu v pneumatike je p = 672 kPa.
7.Koľko molekúl je v guľatej nádobe s vnútorným polomerom 3 cm, naplnenej kyslíkom O2, ktorý má teplotu 27oC a tlak 1,36.10-2Pa.
Riešenie:
Rozbor:
r = 3 cm = 3.10-2m, T = 300,15K, p = 1,36.10-2Pa
k = 1,38.10-23J.K-1, V = 4/3π.r3, N = ?
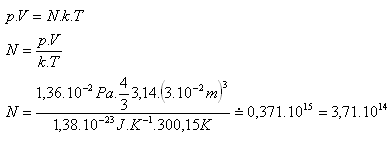
V nádobe je N = 3,71.1014 molekúl kyslíka O2
8.V nádobe je dusík N2 s hmotnosťou 10 kg pri tlaku 10 MPa. Určite hmotnosť dusíka, ktorý treba vypustiť z nádoby, aby sa jeho tlak zmenšil na 2,5 MPa. (Teplota dusíka sa nemení)
Riešenie:
Rozbor:
m1 = 10 kg, p1 = 107Pa, p2 = 2,5.106Pa, T = konštanta
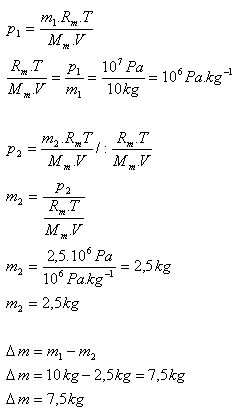
Z nádoby treba vypustiť 7,5 kg dusíka.
9.Hustota dusíka za normálnych podmienok (T1 = 273,15 K a p1 = 101325 Pa) je ρ1 = 1,23 kg.m-3. Určite hustotu dusíka pri teplote 30oC a normálneho tlaku.
Riešenie:
Rozbor:
T1 = 273,15 K, T2 = 303,15 K p1 = p2 = 101325 Pa, ρ1 = 1,23 kg.m-3, ρ2 = ?
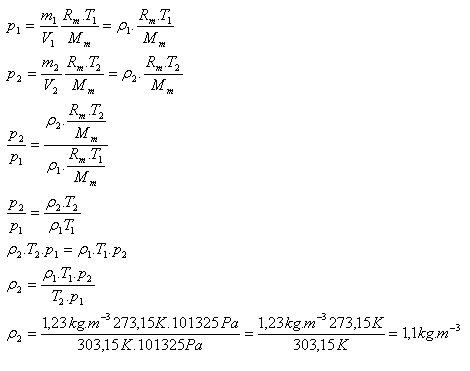
Hustotu dusíka pri teplote 30oC a normálneho tlaku je 1,1 kg.m-3.
10. Vypočítajte efektívnu molovú hmotnosť vzduchu Mm. Vzduch považujeme za zmes 75% dusíka a 25% kyslíka.
Riešenie:
Rozbor:
Mm(N2) = 28.10-3kg.mol-1, m1(N2) = 0,75m
Mm(O2) = 32.10-3kg,mol-1, m2O2) = 0,25m
m = celková hmotnosť vzduchu
Efektívna molová hmotnosť (platí pre dva chemicky nereagujúce plyny)
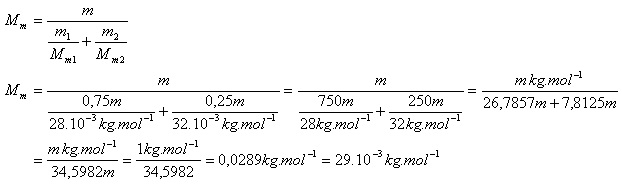
Efektívna molová hmotnosť vzduchu je Mm = 29.10-3.mol-1
11.Ideálny plyn uzavretý v nádobe s vnútorným objemom 2,5 litra má teplotu -13,150C. Aký je jeho tlak, ak v plyne je 1024 molekúl?
Riešenie:
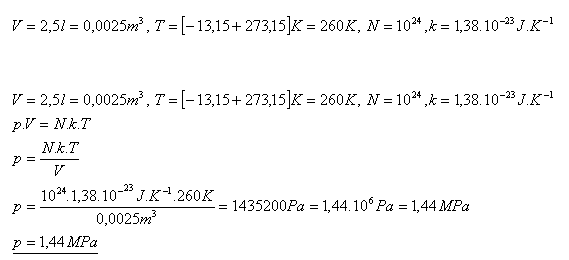
Tlak plynu je 1,44 MPa.
12.Určite objem oxidu uhličitého CO2 s hmotnosťou 1 gram pri teplote 210C a tlaku 1,0 kPa.
Riešenie:
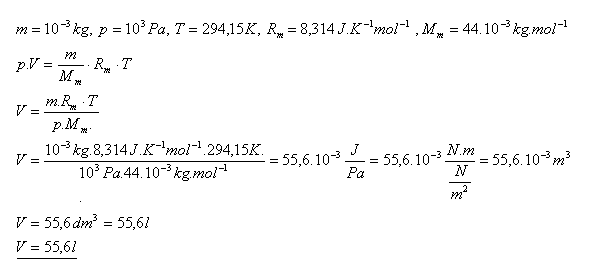
Objem oxidu uhličitého CO2 je 55,6 litra.
13.Koľko molekúl je obsiahnutých v nádobe s plynom, ktorá má vnútorný objem 1 liter, ak plyn má teplotu 100C a tlak 0,2 MPa?
Riešenie:
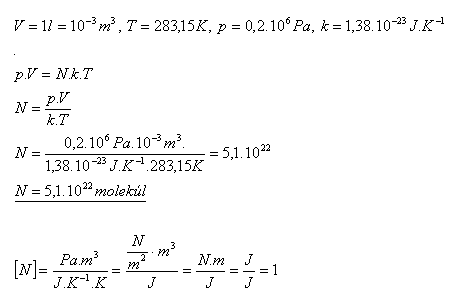
V nádobe je 5,1.1022 molekúl.
14.Ideálny plyn uzavretý v nádobe má objem 1,3 m3 a teplotu -13,150C. Aký je tlak tohto plynu, ak jeho látkové množstvo je 4 kilomoly?
Riešenie:
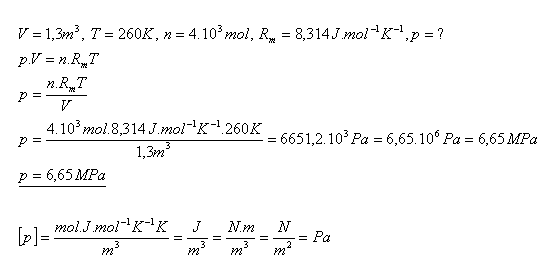
Tlak ideálneho plynu je 6,65 MPa.
15.Určite objem kyslíka O2 s hmotnosťou 8 gramov pri teplote 210C a tlaku 1,4.105Pa.
Riešenie:
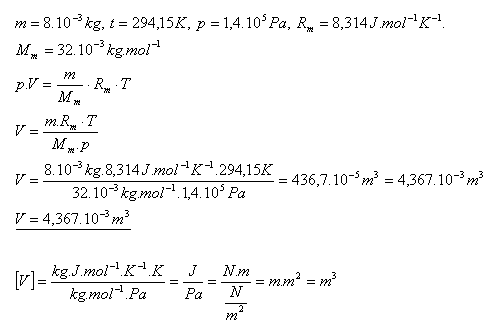
Objem kyslíka je 4,367.10-3m3.
16.V nádobe s objemom 5.10-3m3 je uzavretý dusík N2 pri teplote 390C a tlaku 1,6.105Pa. Určite hmotnosť dusíka.
Riešenie:
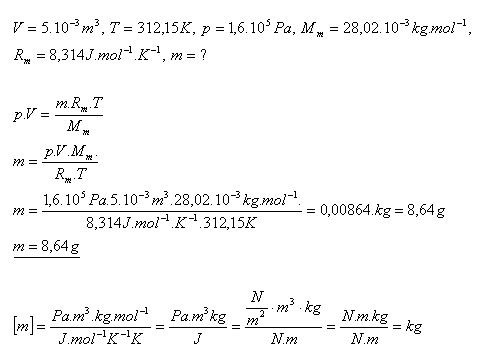
Hmotnosť dusíka N2 je 8,64 gramov.
17.Určite molovú hmotnosť plynu, ktorý má pri teplote 00C a tlaku 100 kPa hustotu 1,95 kg.m-3. O ktorý plyn sa jedná?
Riešenie:
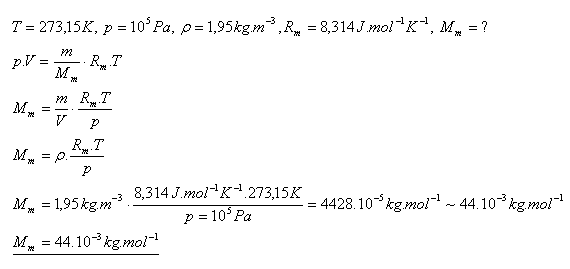
Je to oxid uhličitý CO2.
18.Hustota vzduchu pri normálnych podmienkach je 1,27 kg.m-3. Určite hustotu vzduchu pri teplote 300C a normálnom tlaku.
Riešenie:
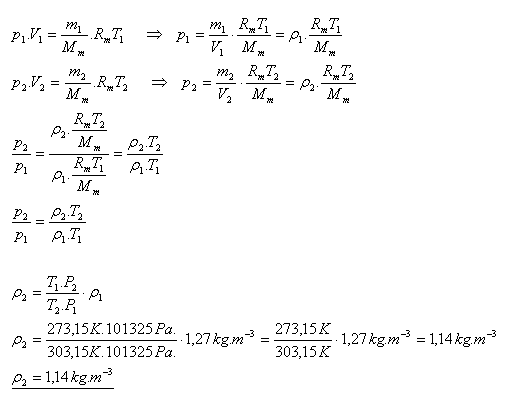
Hustota vzduchu pri teplote 300C a normálnom tlaku je 1,14 kg.m-3.
19.Ako sa zmení objem ideálneho plynu, keď sa jeho termodynamická teplota zväčší dvakrát a tlak sa zvýši o 25%.
Riešenie:
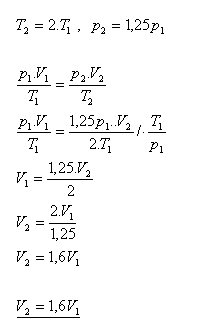
Objem ideálneho plynu sa zväčší 1,6 krát.
20.Ukážte, že ľubovoľný ideálny plyn má pri normálnych podmienkach ( p0 = 101325 Pa, T0 = 273,15 K ) rovnaký molový objem V0 = 22,4 liter.mol-1.
Riešenie: