Stechiometria zlúčenín
Stechiometria sa zaoberá kvantitatívnymi vzťahmi medzi atómami prvkov v molekulách zlúčenín a vzťahmi medzi látkami, ktoré sa zúčastňujú chemických reakcií.
Stechiometrický vzorec udáva pomocou malých celých čísel, v akom pomere sú zastúpené atómy prvkov v zlúčenine, ktorú tvoria.
Molekulový vzorec udáva počet atómov v molekule, napr. molekulový vzorec peroxidu vodíka je H2O2 a stechiometrický vzorec HO. Molekulový vzorec je buď zhodný so stechiometrickým, alebo je jeho celočíselným násobkom.
Najbežnejšie spôsoby vyjadrenia zloženia zlúčenín sú:
- Pomer hmotností prvkov tvoriacich zlúčeninu. Pre zlúčeninu zloženia AxByOz platí:
m(A) ∶m(B) ∶m(O)=M(A) .x ∶ M(B).y ∶ M(O).z, kde m sú hmotnosti a M sú mólové hmotnosti prvkov A, B a O.
- Hmotnostný zlomok wB udávajúci aká hmotnosť zložky B pripadá na jednotkovú hmotnosť zlúčeniny.
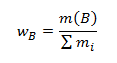 ,
,
kde mi je hmotnosť jednotlivých zložiek zlúčeniny. Súčet hmotnostných zlomkov všetkých zložiek, ktoré danú zlúčeninu tvoria, je rovný 1:
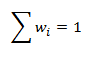
- Hmotnostné percento, ktoré vyjadruje hmotnosť zložky B pripadajúcu na 100 g (kg) zlúčeniny.
hmotnostné percento= 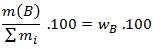
- Molový zlomok xB vyjadrujúci aké látkové množstvo zložky B pripadá na jednotkové látkové množstvo všetkých zložiek. Molový zlomok je definovaný vzťahom:
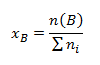
kde ni sú látkové množstvá jednotlivých zložiek zlúčeniny. Súčet molových zlomkov všetkých zložiek zlúčeniny je rovný 1:
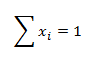
- Objemový zlomok i-tej zložky φi je podiel objemu i-tej zložky Vi a objemu celej sústavy V
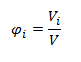
- Objemové percento (obj.%) dostaneme, keď vynásobíme objemový zlomok číslom 100:
obj.%=φi.100