Látkové charakteristiky
1.Ktoré fyzikálne veličiny charakterizujú látku?
Riešenie:

2.Určite pokojové hmotnosti atómov prvkov H, C, Zn. Aká je relatívna hmotnosť Uránu, ak jeho pokojová hmotnosť je ma(U) = 3,95.10-25kg. Využite tabuľky.
Riešenie:
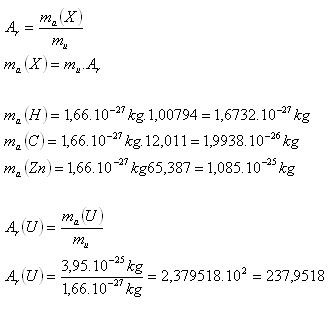
Relatívna hmotnosť Uránu je asi Ar(U) =238
3.Určite približný počet atómov, ktoré sú obsiahnuté v železnom závaží s hmotnosťou 1 kg. Aký dlhý rad by vznikol zoradením všetkých týchto atómov tesne vedľa seba do jednej priamky. Priemer atómu je asi 10-10m.
Riešenie:
Rozbor:
m = 1 kg, d = 10-10m, mu = 1,66.10-27kg, Ar(Fe) = 55,847
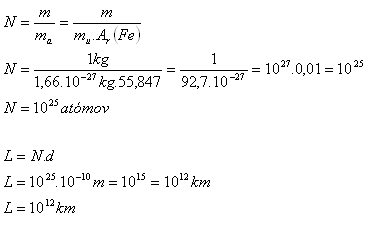
V jednom kilograme železa je 1025 atómov. Dĺžka radu zostaveného z týchto atómov by bola 1012km. Je to dĺžka asi 6600 krát väčšia ako vzdialenosť Zem – Slnko.
4. Určite počet elektrónov, ktoré sú obsiahnuté v medi s hmotnosťou 1g. Aká je ich celková hmotnosť, ak hmotnosť jedného elektrónu je 9,1.10-31kg?
Prihláste sa pre zobrazenie riešenia5.Zistite, či molekula kyseliny dusičnej HNO3 má väčšiu hmotnosť ako molekula oxidu strieborného Ag2O. Použite tabuľky.
Prihláste sa pre zobrazenie riešenia
6.Vypočítajte, aké látkové množstvo predstavuje 4,82.1024 atómov vodíka.
Prihláste sa pre zobrazenie riešenia
7.Určite látkové množstvo vody s objemom 3,6 l.
Prihláste sa pre zobrazenie riešenia8.Zistite, či možno naliať do valca s objemom 10 cm3 vodu s látkovým množstvom 1 mol.
Prihláste sa pre zobrazenie riešenia
9.Miestnosť má rozmery a = 4m, b = 4m, c = 3m. Koľko je v nej molekúl vzduchu? (Mm = 29.10-3kg.mol-1, ρ = 1,276kg.m-3)
Prihláste sa pre zobrazenie riešenia
10. Z povrchu vodnej kvapky s objemom 1 mm3 sa za 1 sekundu vyparí voda obsahujúca asi 1016 molekúl. Za aký čas sa vyparí celá kvapka?
Prihláste sa pre zobrazenie riešenia
11. Určite relatívnu molekulovú hmotnosť oxidu uhličitého CO2 a pokojovú hmotnosť molekuly CO2. Použite tabuľky.(mu = 1,6605.10-27kg)
Prihláste sa pre zobrazenie riešenia
12. V uzavretej nádobe umiestenej vo vákuu je plynný oxid uhličitý s hmotnosťou 1,1 kg. Z nádoby uniká za 1 sekundu priemerne N‘ = 1,5.1020 molekúl. Za aký čas uniknú z nádoby všetky molekuly CO2.
Prihláste sa pre zobrazenie riešenia
13.Vypočítajte molový objem olova.
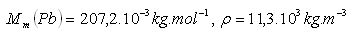
14. Priemer molekuly kyslíka O2 je 0,364 nm. Aký dlhý by bol rad, ktorý by vznikol tesným zoradením všetkých molekúl, ktoré sú obsiahnuté v jednom mole kyslíka.
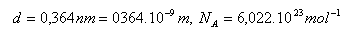
15. V nádobe s objemom 2 litre sa nachádza 2,74.1019molekúl chlóru Cl2. Vypočítajte hustotu molekúl NV tohto plynu.
16.Vypočítajte strednú kvadratickú rýchlosť vk molekuly chlóru Cl2 pri teplote 1000C.
Prihláste sa pre zobrazenie riešenia17.Vypočítajte strednú kinetickú energiu jednej molekuly ideálneho plynu pri teplote t = -200C.(k = 1,38.10-23J.K-1)
Prihláste sa pre zobrazenie riešenia18.Zistite priemer molekuly vody H2O.
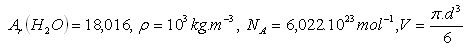
19. Vzorka kyslíka O2 s hmotnosťou 5 kg má pri teplote 00C a tlaku 0,1 MPa objem 3,54 m3. Určite molový objem kyslíka.
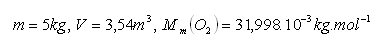
20.Vypočítajte aký počet molekúl obsahuje vodík H2 s látkovým množstvom n1 = 10 mol a kyselina olejová C17H33COOH s rovnakým látkovým množstvom n2 = 10 mol.
Prihláste sa pre zobrazenie riešenia