Stoffeigenschaften
1.Welche physikalischen Größen charakterisieren einen Stoff?
Lösung:
Atom AZX
-
Z – Protonenzahl (Anzahl der Protonen im Kern, Anzahl der Elektronen in der Hülle, Ordnungszahl des Elements im Periodensystem nach Mendelejew)
-
A – Nukleonenzahl (Anzahl der Protonen und Neutronen im Kern)
-
N=A−Z – Anzahl der Neutronen im Kern
Relative Atommasse
Relative Molekülmasse
Stoffmenge n – charakterisiert einen Stoff anhand der Anzahl der darin enthaltenen Teilchen
1 mol – die Einheit der Stoffmenge. Ein Mol ist auch die Stoffmenge, die ebenso viele Teilchen enthält, wie Atome in 0.012kg von 612C.
Avogadro-Konstante:
Molmasse:
Molvolumen:
2.Bestimmen Sie die Ruhemasse der Atome der Elemente H, C, Zn. Wie groß ist die relative Masse von Uran, wenn seine Ruhemasse ma(U) = 3.95·10-25 kg ist. Verwenden Sie Tabellen.
Lösung:
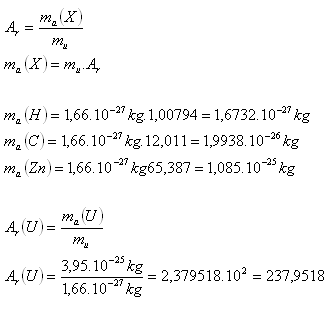
Die relative Masse von Uran ist näherungsweise Ar(U) = 238
3.Schätzen Sie die ungefähre Anzahl der Atome in einem Eisen-Gewicht mit der Masse 1 kg. Wie lang wäre eine Linie, wenn all diese Atome dicht aneinandergereiht in einer einzigen Geraden lägen? Der Durchmesser eines Atoms beträgt etwa 10-10 m.
Lösung:
Analyse:
m = 1 kg, d = 10-10 m, mu = 1.66·10-27 kg, Ar(Fe) = 55.847
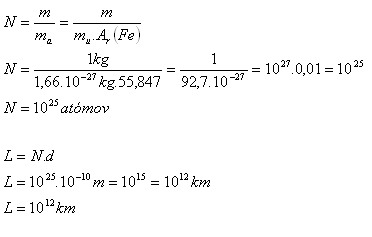
In einem Kilogramm Eisen befinden sich 1025 Atome. Die Länge der von diesen Atomen gebildeten Linie wäre 1012 km. Das ist etwa 6600-mal größer als die Entfernung Erde–Sonne.
4.Bestimmen Sie die Anzahl der in 1 g Kupfer enthaltenen Elektronen. Wie groß ist ihre Gesamtmasse, wenn die Masse eines einzelnen Elektrons 9.1·10-31 kg beträgt?
Lösung:
Analyse:
m = 1 g = 10-3 kg, me = 9.1·10-31 kg, mu = 1.66·10-27 kg, Ar(29Cu) = 63.546
Ruhemasse eines Cu-Atoms:
ma(Cu) = mu·Ar(Cu)
ma(Cu) = 1.66·10-27 kg · 63.546 = 105.486·10-27 kg
Anzahl der Atome:
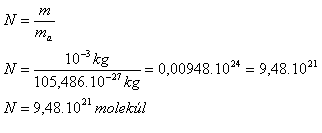
Anzahl der Elektronen:
29Cu – jedes Atom hat 29 Elektronen
N‘ = 29·N = 29·9.48·1021 = 2.75·1023
Gesamtmasse aller Elektronen:
m = N‘·me = 2.75·1023 · 9.1·10-31 kg = 25·10-8 kg
In einem Gramm Kupfer gibt es 2.75·1023 Elektronen, die eine Masse von 25·10-8 kg haben.
5.Finden Sie heraus, ob ein Molekül Salpetersäure HNO3 eine größere Masse hat als ein Molekül Silberoxid Ag2O. Verwenden Sie Tabellen.
Lösung:
HNO3
Ar(H) = 1.008
Ar(N) = 14.010
3·Ar(O) = 48.000
Ar(HNO3) = 63.018 m(HNO3) = 63.018·1.66·10-27 kg
m(HNO3) = 1.46·10-25 kg
Ag2O
2·Ar(Ag) = 215.74
Ar(O) = 16.00
Ar(Ag2O) = 231.74 m(Ag2O) = 231.74·1.66·10-27 kg
m(Ag2O) = 3.8469·10-25 kg
m(Ag2O) > m(HNO3)
Die Annahme ist nicht korrekt.
6.Berechnen Sie die Stoffmenge, die 4.82·1024 Wasserstoffatomen entspricht.
Lösung:
Analyse:
N = 4.82·1024 Wasserstoffatome, NA = 6.022·1023 mol-1
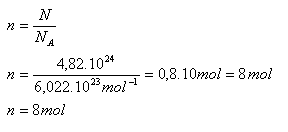
Die angegebene Anzahl von Wasserstoffatomen entspricht n = 8 Mol.
7.Bestimmen Sie die Stoffmenge von Wasser mit dem Volumen 3.6 L.
Lösung:
Analyse:
V = 3.6 L, m = 3.6 kg,
2·Ar(H) = 2.016
Ar(O) = 16.000
Ar(H2O) = 18.016
Mm = 18.016·10-3 kg·mol-1
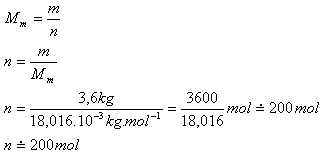
Das Volumen 3.6 Liter Wasser entspricht 200 Mol.
8.Prüfen Sie, ob Wasser mit der Stoffmenge 1 mol in einen Zylinder mit dem Volumen 10 cm3 eingefüllt werden kann.
Lösung:
Analyse:
n = 1 mol, V = 10 cm3, Mm = 18.016·10-3 kg (siehe Beispiel 7), ρ = 103 kg·m-3
Volumen eines Mols Wasser:
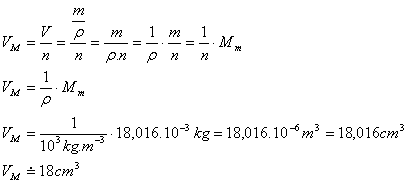
Volumen des Zylinders VV = 10 cm3
VM > VV
Das Wasser kann nicht in den Zylinder gegossen werden, weil das Volumen eines Mols Wasser 18 cm3 beträgt und der Behälter nur 10 cm3 fasst.
9.Ein Raum hat die Abmessungen a = 4 m, b = 4 m, c = 3 m. Wie viele Moleküle Luft befinden sich darin? (Mm = 29·10-3 kg·mol-1, ρ = 1.276 kg·m-3)
Lösung:
Analyse:
V = a·b·c
V = 4 m · 4 m · 3 m = 48 m3,
Mm = 29·10-3 kg·mol-1, ρ = 1.276 kg·m-3
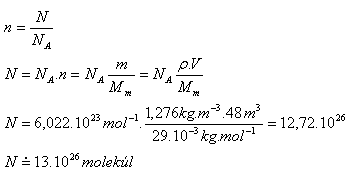
Im Raum befinden sich ungefähr 1.3·1027 Moleküle.
10.Von der Oberfläche eines Wassertropfens mit dem Volumen 1 mm3 verdampft in 1 Sekunde Wasser, das etwa 106 Moleküle enthält. In welcher Zeit verdampft der gesamte Tropfen?
Lösung:
Analyse:
V = 1 mm3 = 10-9 m3, N‘ = 1016 s-1, Mm(H2O) = 18.016·10-3 kg·mol-1
ρ = 1000 kg·m-3, NA = 6.022·1023 mol-1
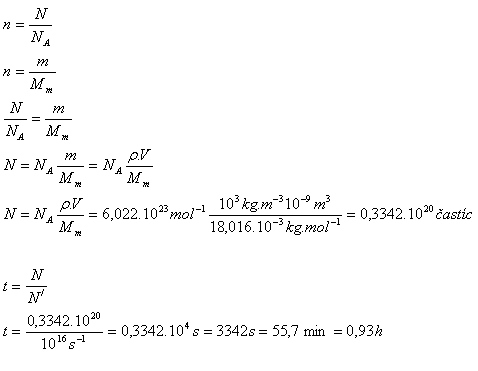
Der gesamte Tropfen verdampft in etwas weniger als 1 Stunde.