Berechnung der stöchiometrischen Formel
1.Beim Verbrennen von 3 g Magnesium wurden 5 g Magnesiumoxid erhalten. Gib die Zusammensetzung dieses Oxids durch das Massenverhältnis der beiden Elemente an.
Lösung:
Bei der Verbrennung von Magnesium wurden 5–3 = 2 g Sauerstoff verbraucht. Die Zusammensetzung von Magnesiumoxid, ausgedrückt als Massenverhältnis der Elemente, lautet:
m(Mg): m(O) = 3∶2
2.Bestimme die empirische Formel einer Verbindung, die 32,43 % Natrium, 22,55 % Schwefel und 45,02 % Sauerstoff enthält.
Lösung:
Aus der prozentualen Zusammensetzung der Verbindung folgt logisch, dass 100 g der Verbindung 32,43 g Natrium, 22,55 g Schwefel und 45,02 g Sauerstoff enthalten. Um die Verhältnisse der Elemente in der Verbindung zu bestimmen, benötigen wir die molaren Verhältnisse, die mithilfe der Molmassen berechnet werden (Werte aus dem Periodensystem der Elemente):
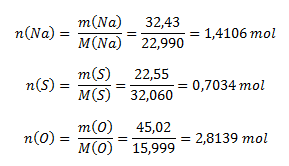
Das Verhältnis der Stoffmengen der Elemente in der Verbindung ist:
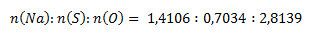
Die erhaltenen Verhältnisse werden durch Division durch den kleinsten Wert auf ganze Zahlen gebracht:
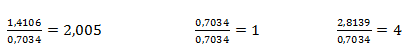
Somit entsprechen auf ein Mol Schwefel 4 Mol Sauerstoff und zwei Mol Natrium. Die empirische Formel ist Na2SO4, Natriumsulfat.
3.Eine Verbindung enthält 2,2 % Wasserstoff, 26,6 % Kohlenstoff und 71,2 % Sauerstoff. Die relative Molekülmasse der Verbindung beträgt 90,034. Bestimme ihre Molekülformel.
Lösung:
Wie im zweiten Beispiel bestimmen wir zunächst die molaren Verhältnisse der Elemente in der Verbindung.
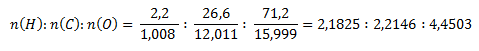
Das kleinste molare Verhältnis erhält man durch Division durch den Wert für Wasserstoff:
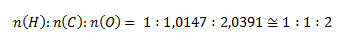
Nach diesem Verhältnis lautet die stöchiometrische Formel HCO2. Die relative Molekülmasse einer solchen Verbindung wäre 45,017, also genau die Hälfte des gegebenen Werts. Um den angegebenen Wert 90,034 zu erhalten, müssen die Elemente im Molekül verdoppelt werden. Die Molekülformel lautet daher C2H2O4.
4.Die qualitative Analyse ergab, dass eine organische flüssige Substanz Kohlenstoff, Wasserstoff und Sauerstoff enthält. Vorversuche zeigten, dass die Substanz keine reduzierenden Eigenschaften besitzt und Universalindikatorpapier rot färbt.
Die quantitative Analyse ergab, dass die Substanz 39,85 % Kohlenstoff und 6,75 % Wasserstoff enthält. Bestimme die stöchiometrische und die Molekülformel der Substanz.
Lösung:
Anhand der bekannten Massenanteile von Kohlenstoff und Wasserstoff können wir den Massenanteil von Sauerstoff berechnen:
w(O) = 100 – (39,85 + 6,75) = 53,40 %
Wir gehen wie im vorherigen Beispiel vor und berechnen die Stoffmengen
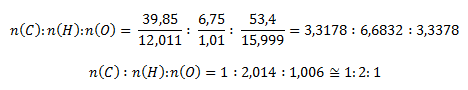
Geringe Abweichungen von ganzen Zahlen entstehen durch Ungenauigkeiten bei der Bestimmung des Kohlenstoff- und Wasserstoffgehalts. Die stöchiometrische Formel ist CH2O. Die Molekülformel kann C2H4O2, C3H6O3 usw. sein. Die Verbindung zeigt jedoch saure Eigenschaften (nach der roten Färbung des Indikatorpapiers). Dies passt zu C2H4O2, d. h. CH3COOH, Essigsäure, eine Säure ohne reduzierende Eigenschaften.
5.Eine als Cobalt(II)-sulfat-Heptahydrat bezeichnete Substanz wurde einer Thermoanalyse unterzogen. Die Temperatur wurde so gewählt, dass das gesamte Wasser verdampfte. Es wurden 0,2568 g der Substanz eingewogen. Nach der Zersetzung wog der Rückstand 0,1471 g. Wie lautet die tatsächliche Formel der Substanz?
Lösung:
Aus den Ergebnissen der Thermoanalyse ergibt sich die beim Erhitzen verlorene Wassermasse:
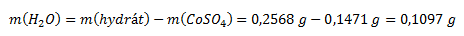
Der Massenanteil von Wasser und wasserfreiem Cobaltsulfat in der Probe wird berechnet als:
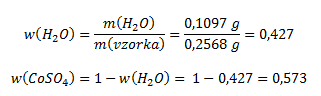
Zur Berechnung des Verhältnisses von Kristallwasser zu wasserfreiem Sulfat teilen wir die erhaltenen Werte durch die Molmassen (und erhalten so das molare Verhältnis):
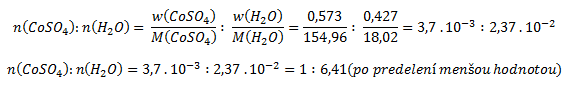
Die Formel der Verbindung lautet CoSO4·6,41H2O, das heißt, das Cobalt(II)-sulfat-Heptahydrat war teilweise „verwittert“.
6.Die Verbindung enthält Kohlenstoff, Wasserstoff und Sauerstoff. Ihre Zusammensetzung wird durch das Massenverhältnis der Elemente angegeben:
m(C) : m(H) : m(O) = 18 : 3 : 8. Bestimme die empirische Formel der Verbindung.
Lösung:
Wir berechnen die den gegebenen Massenverhältnissen entsprechenden Stoffmengen:
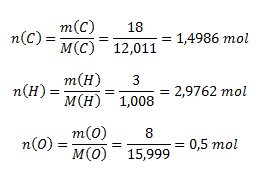
Um ganzzahlige Verhältnisse zu erhalten, multiplizieren wir alle Stoffmengen mit zwei:
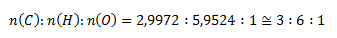
Die empirische Formel der Verbindung ist C3H6O.
7.Bestimme die Molekülformel einer gasförmigen Substanz mit der Zusammensetzung 92,3 % Kohlenstoff und 7,7 % Wasserstoff. Ein Liter dieser Substanz wiegt unter Normbedingungen 1,17 g, während ein Liter Wasserstoff unter denselben Bedingungen 0,09 g wiegt.
Lösung:
Zur Bestimmung der Formel müssen wir die Molmasse der Verbindung berechnen. Wir nehmen an, dass das Verhältnis der Massen der Verbindung und des Wasserstoffs dem Verhältnis ihrer Molmassen entspricht:
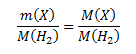
Durch Umstellen berechnen wir die unbekannte Molmasse:
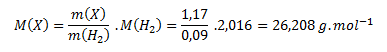
Die berechnete Molmasse wird zur Bestimmung der Stoffmengen der Elemente in einem Mol der Verbindung verwendet:
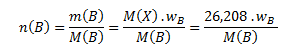
Durch Einsetzen der jeweiligen Werte erhalten wir:
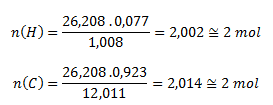
Die Molekülformel der Verbindung ist C2H2 – Acetylen.
8.Eisen reagiert mit Sauerstoff zu einem Oxid, das 77,73 % Eisen enthält. Berechne die Stoffmengen von Eisen und Sauerstoff in 100 g des Oxids und gib ihr Verhältnis in den kleinsten ganzen Zahlen an.
Lösung:
Der Prozentsatz an Sauerstoff muss berechnet werden:
w(O) = 100 – 77,73 = 22,27 %
Als Nächstes berechnen wir die entsprechenden Stoffmengen der Elemente in der Verbindung:
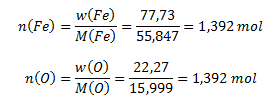
Die Stoffmengen von Eisen und Sauerstoff im Oxid sind identisch, 1,392 mol, daher ist ihr Verhältnis 1 : 1.
9. Bestimme die stöchiometrische und die Molekülformel einer Substanz, in der das Massenverhältnis von Kohlenstoff, Wasserstoff und Sauerstoff 12 : 1 : 32 beträgt.
Lösung:
Wir berechnen die Stoffmengen der Elemente:
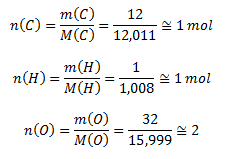
Die stöchiometrische Formel ist CH2O, die Molekülformel hat verdoppelte Koeffizienten und entspricht der Oxalsäure H2C2O4.
10. Die chemische Analyse zeigte, dass eine Substanz 1,5 % Wasserstoff, 56,4 % Arsen und 42,1 % Sauerstoff enthält. Bestimme die stöchiometrische Formel.
Lösung:
Die Verbindung besitzt die stöchiometrische Formel HxAsyOz. Die Indizes x, y und z werden wie folgt bestimmt:
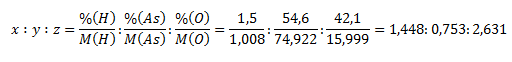
Die Verhältnisse werden auf kleine ganze Zahlen gebracht: x ∶ y ∶ z = 4 ∶ 2 ∶ 7
Die stöchiometrische Formel der Verbindung ist H4As2O7 – Pyroarsensäure.