Výpočet stechiometrického vzorce
1.Pri horení 3 g horčíka sa získalo 5 g oxidu horčíka. Vyjadrite zloženie tohto oxidu pomerom hmotností oboch prvkov.
Riešenie:
Pri horení horčíka sa spotrebovalo 5-3 = 2 g kyslíka. Zloženie oxidu horčíka vyjadrené pomerom hmotností prvkov je:
m(Mg): m(O)= 3∶2
2.Určte empirický vzorec zlúčeniny obsahujúcej 32,43 % sodíka, 22,55 % síry a 45,02 % kyslíka.
Riešenie:
Z percentuálneho zloženia zlúčeniny logicky vyplýva, že 100 g zlúčeniny obsahuje 32,43 g sodíka, 22,55 g síry a 45,02 g kyslíka. Pre stanovenie pomerov prvkov v zlúčenine potrebujeme poznať pomer látkových množstiev, ktoré vypočítame pomocou vzorca na výpočet mólovej hmotnosti (používame hodnoty mólových hmotností z PSP- periodickej sústavy prvkov):
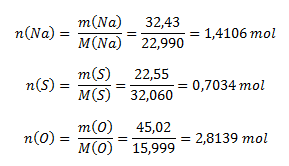
Pomer látkových množstiev prvkov v zlúčenine je:
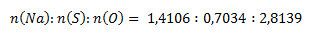
Získané pomery prvkov upravíme na celé čísla tak, že zistené hodnoty predelíme najmenšou z nich:
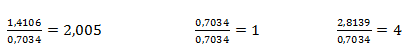
Na jeden mol síry teda pripadajú 4 mol kyslíka a dva moly sodíka. Empirický vzorec zlúčeniny je Na2SO4, síran sodný.
3.Istá zlúčenina obsahuje 2,2 % vodíka, 26,6 % uhlíka a 71,2 % kyslíka. Relatívna molekulová hmotnosť zlúčeniny je 90,034. Zistite molekulový vzorec zlúčeniny.
Riešenie:
Podobne ako v druhom príklade najprv zistíme pomer látkových množstiev prvkov v zlúčenine.
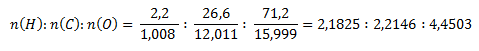
Najmenší pomer látkových množstiev získame predelením hodnotou pre vodík:
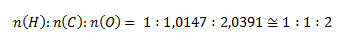
Podľa tohto pomeru je stechiometrický vzorec zlúčeniny HCO2. Relatívna molekulová hmotnosť takejto zlúčeniny by bola 45,017, čo predstavuje presne polovicu zo zadanej hodnoty. Pre získanie zadanej hodnoty 90,034 sa musia prvky nachádzať v zlúčenine dvojnásobne, molekulový vzorec zlúčeniny teda je C2H2O4.
4.Kvalitatívnou analýzou sa dokázalo, že organická kvapalná látka obsahuje uhlík, vodík a kyslík. Orientačné skúšky ukázali, že látka nemá redukčné vlastnosti a univerzálny indikátorový papierik sfarbí na červeno.
Kvantitatívnou analýzou sa stanovilo, že látka obsahuje 39,85 % uhlíka a 6,75 % vodíka. Zistite stechiometrický a molekulový vzorec látky.
Riešenie:
Zo známych hmotnostných zlomkov uhlíka a vodíka vieme dopočítať hmotnostný zlomok kyslíka:
w(O) = 100 – (39,85 + 6,75) = 53,40 %
Ďalej postupujeme identicky ako v predchádzajúcom príklade, zistíme látkové množstvá
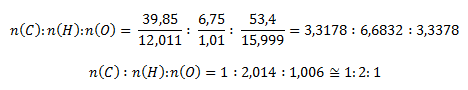
Malé odchýlky od celých čísel vyplývajú z nepresnosti pri kvantitatívnom stanovení uhlíka a vodíka v zlúčenine. Stechiometrický vzorec zlúčeniny je CH2O. Molekulový vzorec môže byť aj C2H4O2, C3H6O3 atď. Zlúčenina má však kyslé vlastnosti (podľa červeného sfarbenia indikátorového papierika). Tejto podmienke vyhovuje C2H4O2, resp. CH3COOH, kyselina octová, čo je kyslina bez redukčných vlastností.
5.Látka označená na štítku ako heptahydrát síranu kobaltnatého sa podrobila termickej analýze. Pri termickom rozklade sa zvolila taká teplota, aby zo vzorky unikla všetka voda. Navážilo sa 0,2568 g látky. Po termickom rozklade mal zvyšok hmotnosť 0,1471 g. Aký je skutočný vzorec látky?
Riešenie:
Z výsledku termickej analýzy vyplýva, že pri zohrievaní unikla zo vzorky voda, ktorej hmotnosť bola:
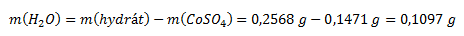
Hmotnostný zlomok vody a bezvodého síranu kobaltnatého vo vzorke vypočítame podľa vzťahu:
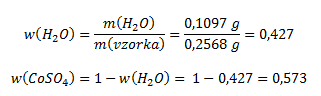
Pre výpočet pomeru kryštálovej vody a bezvodého síranu je potrebné získané hodnoty predeliť mólovými hmotnosťami (získame tak pomer látkových množstiev)
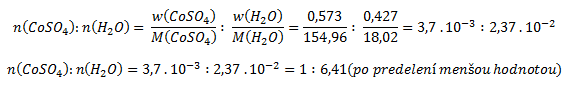
Vzorec zlúčeniny je CoSO4 . 6,41 H2O, heptahydrát síranu kobaltnatého bol teda čiastočne „zvetraný“.
6.Zlúčenina obsahuje uhlík, vodík a kyslík. Jej zloženie je dané pomerom hmotností prvkov:
m(C) : m(H) : m(O) = 18 : 3 : 8. Zistite empirický vzorec zlúčeniny.
Riešenie:
Vypočítame látkové množstvá zodpovedajúce uvedenému hmotnostnému zastúpeniu prvkov v zlúčenine:
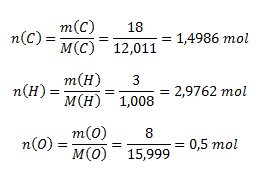
Aby sme dostali celočíselný pomer, vynásobíme všetky vypočítané látkové množstvá dvoma a dostaneme
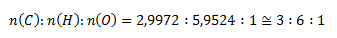
Empirický vzorec zlúčeniny je C3H6O.
7.Zistite molekulový vzorec plynnej látky, ktorá má zloženie 92,3 % uhlíka a 7,7 % vodíka. Jeden liter tejto látky má za normálnych podmienok hmotnosť 1,17 g a jeden liter vodíka má za tých istých podmienok hmotnosť 0,09 g.
Riešenie:
Pre zistenie vzorca potrebujeme vypočítať mólovú hmotnosť zlúčeniny. Vychádzame v predpokladu, že pomer hmotností zlúčeniny a vodíka je rovný pomeru ich mólových hmotností:
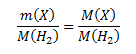
Úpravou vzorca vypočítame neznámu mólovú hmotnosť:
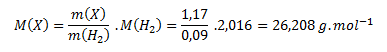
Vypočítanú mólovú hmotnosť použijeme na zistenie látkových množstiev prvkov v jednom mole zlúčeniny podľa vzťahu:
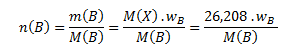
Dosadením príslušných hodnôt dostaneme:
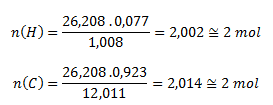
Molekulový vzorec zlúčeniny teda je C2H2- acetylén
8.Železo sa zlučuje s kyslíkom na oxid obsahujúci 77,73 % železa. Vypočítajte látkové množstvá železa a kyslíka v 100g oxidu a ich pomer vyjadrite malými celými číslami.
Riešenie:
Percentuálny obsah kyslíka musíme dopočítať:
w(O) = 100 – 77,73 = 22,27%
Následne vypočítame zodpovedajúce látkové množstvá prvkov v zlúčenine:
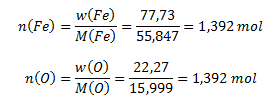
Látkové množstvá železa a kyslíka v oxide sú totožné, 1,392 mol, ich pomer je teda 1 : 1.
9. Určte stechiometrický a molekulový vzorec látky, v ktorej hmotnostný pomer uhlíka, vodíka a kyslíka je
12 : 1 : 32.
Riešenie:
Vypočítame látkové množstvá zložiek:
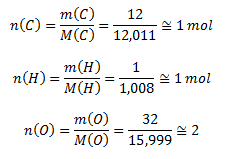
Stechiometrický vzorec je teda CH2O, molekulový vzorec má dvojnásobné koeficienty, ide o kyselinu šťaveľovú H2C2O4.
10. Chemickou analýzou látky bolo zistené, že obsahuje 1,5 % vodíka, 56,4 % arzénu a 42,1% kyslíka. Určte stechiometrický vzorec.
Riešenie:
Zlúčenina má stechiometrický vzorec HxAsyOz. Indexy x,y a z zistíme nasledovne:
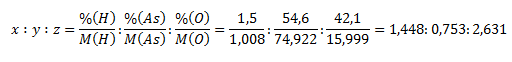
Pomery upravíme na pomer celých malých čísel x ∶ y ∶ z = 4 ∶ 2 ∶ 7
Stechiometrický vzorec zlúčeniny je H4As2O7- kyselina tetrahydrogendifosforečná