Iontové rovnice
Ión je atóm alebo molekula s nenulovým nábojom, teda celkový počet jeho elektónov sa nerovná počtu jeho protónov. Tendencia tvoriť ióny záleží na elektronegativite každého prvku. Ak počet elektrónov prevyšuje počet protónov, atom alebo molekula je záporne nabitá. Takúto časticu nazývame anión. Pokiaľ počet protónov prevyšuje počet elektrónov, častica je nabitá kladne a nazývame ju katión.
Ióny rozlišujeme na monoatómové (Na+, Cl-, Cu2+, Ir3+…), molekulové (OH-, CO32-, HS-…) a komplexné ([Fe(CN)6]4-, [Cu(H2O)6]2+, [Cu(H2O)2(NH3)4]2+, [HgI4]2-…)
Iónové rovnice sú chemické rovnice, ktorými zapisujeme reakcie iónov vo vodných roztokoch kyselín, hydroxidov a solí. Aby mohli tieto reakcie prebiehať, musí byť splnená aspoň jedna podmienka z nasledujúcich:
- Tvorí sa nerozpustná látka- zrazenina
- Tvorí sa slabý elektrolyt
- Tvorí sa plynná látka
- Mení sa oxidačné číslo atómov
Ako celé molekuly zapisujeme slabé elektrolyty (NH4OH, H2S, HCN, H2O…), plyny (CO2, SO2, SO3, NH3, Cl2, NO…) a zrazeniny (AgBr, CaCO3, AgCl, PbI2…).
1. Uvedenú chemickú rovnicu zapíšte v iónovom tvare:
Riešenie:
Na ióny môžeme zapísať len vzorce silných kyselín a zásad a solí dobre rozpustných vo vode. Ostatné látky nerozpisujeme:
2.Napíšte iónový zápis zrážacej reakcie kyseliny sírovej s chloridom bárnatým.
Riešenie:
Najprv zapíšeme rovnicu v stechiometrickom tvare:
Následne rozpíšeme disociácie:
Výsledná rovnica:
3.Uvedené rovnice sú zápisom zrážacích reakcií. Zapíšte ich v iónovom tvare:
Riešenie:
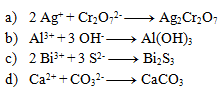
4.Uvedené rovnice sú zápisom komplexotvorných reakcií. Rovnice napíšte v iónovom tvare:
Riešenie:
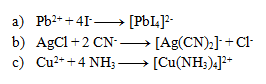
5.Vyčíslite nasledujúce iónové rovnice. Dbajte nielen na súčet atómov prvkov, ale aj na súčet náboja na oboch stranách.
Riešenie:
- a) 1,2,1,6,4
- b) 1,1,2,1,1
- c) 2,1,4,1,1,2
- d) 1,1,1,1,2
- e) 2,1,4,1,1,2
- f) 3,2,1,2
- g) 1,1,2,1,1,1
6. Napíšte iónový zápis a skrátený iónový zápis reakcie chloridu sodného s dusičnanom strieborným.
Riešenie:
Najpr si napíšeme stechiometrickú rovnicu reakcie a vyčíslime ju:
AgNO3 + NaCl → AgCl↓ + NaNO3
Následne rozpíšeme všetky zlúčeniny do iónového tvaru, okrem zrazeniny:
Ag+ + NO3- + Na+ +Cl- → AgCl↓ + Na+ + NO3-
Ak vynecháme na oboch stranách rovnice ióny, ktoré sa opakujú (a nezúčastnňujú sa samotnej zrážacej reakcie), dostaneme skrátenú iónovú rovnicu:
Ag+ + Cl- → AgCl↓
7. Zistite stechiometrické koeficienty v nasledujúcej chemickej rovnici:
[SnCl3]– + H2O → [Sn3(OH)4]2+ + H3O+ + Cl–
Riešenie:
V chemickej rovnici sa oxidačné čísla všetkých atómov nemenia, takže nie je redoxná. Vyhľadáme látku, ktorá má najväčšie stechiometrické indexy a budeme predpokladať, že jej stechiometrický koeficient bude 1; v našom prípade to je produkt [Sn3(OH)4]2+. Na pravej strane rovnice teda máme tri atómy cínu, preto na ľavej strane rovnice dáme pred [SnCl3]– koeficient 3:
3[SnCl3]– + H2O → [Sn3(OH)4]2+ + H3O+ + Cl–
Na ľavej strane rovnice sme tým získali 9 atómov chlóru, preto pred Cl– dáme koeficient 9:
3[SnCl3]– + H2O → [Sn3(OH)4]2+ + H3O+ + 9Cl–
Zostal ešte nezistený koeficient pri vode a oxóniovom katióne. Ide o iónovú rovnicu. Využijeme preto pravidlo bilancie nábojových čísiel. Na ľavej strane rovnice je súčet nábojových čísiel: 3 · (–1) + 0 = –3. Na pravej strane rovnice je súčet nábojových čísiel (okrem H3O+): 1 · 2 + 9 · (–1) = –7. Z toho vyplýva, že koeficient H3O+ musí byť 4, aby bol na oboch stranách rovnice rovnaký súčet nábojových čísiel (–3):
3[SnCl3]– + H2O → [Sn3(OH)4]2+ + 4H3O+ + 9Cl–
Na pravej strane máme 4 + 4 · 3 = 16 atómov vodíka, z čoho vyplýva, že na ľavej strane rovnice musí mať voda koeficient 8:
3[SnCl3]– + 8H2O → [Sn3(OH)4]2+ + 4H3O+ + 9Cl–
Získali sme koeficienty pre všetky látky v rovnici. Správnosť stechiometrických koeficientov overíme spočítaním atómov kyslíka na oboch stranách rovnice (8 = 8). Keďže získané stechiometrické koeficienty (3, 8 = 1, 4, 9) už okrem čísla 1 nemajú žiadneho spoločného deliteľa, vyčísľovanie chemickej rovnice je ukončené.
8. Pôsobením chloridu bárnatého na síran horečnatý vzniká zrazenina síranu bárnatého. Napíšte skrátenú iónovú rovnicu daného chemického procesu.
Riešenie:
Najprv si napíšeme úplnú chemickú rovnicu:
BaCl2 + MgSO4 → BaSO4 + MgCl2
Reakcie prebiehajú v roztoku, jedná sa teda o reakcie voľne sa pohybujúcich iónov. BaSO4 je zrazenina slabo rozpustná vo vode, preto ju nerozpisujeme na samostatné ióny:
Ba2+ + 2Cl- + Mg2+ + SO42-→ BaSO4↓ + Mg2+ +2Cl-
Ak vynecháme na oboch stranách rovnice ióny, ktoré sa opakujú (a nezúčastnňujú sa samotnej zrážacej reakcie), dostaneme skrátenú iónovú rovnicu:
Ba2++ SO42-→ BaSO4↓
9. Rozpúšťanie zrazeniny fosforečnanu vápenatého pomocou kyseliny dusičnej môžeme zapísať chemickou rovnicou:
Ca3(PO4)2↓ + 6HNO3 → 3Ca(NO3)2 + 2H3PO4
Napíšte iónovú a skrátenú iónovú rovnicu pre tento dej.
Riešenie:
Iónová rovnica:
Ca3(PO4)2↓ + 6H+ + 6NO3- → 3Ca2+ + 6NO3- + 6H+ + 2PO42-
Skrátená iónová rovnica:
Ca3(PO4)2 ↓→ 3Ca2 + 2PO42- alebo Ca3(PO4)2↓ + 6H+→ 3Ca2+ + 2H3PO4
10. Zostavte iónovú rovnicu reakcie hydroxidu sodného s kyselinou sírovou.
Riešenie:
Najprv si napíšeme úplnú chemickú rovnicu a vyčíslime ju:
H2SO4 + 2NaOH → Na2SO4 + 2H2O
Oba reaktanty sú v roztoku úplne disociované, jedná sa totiž o silnú kyselinu a silnú zásadu. Vznikajúci síran sodný je vo vode dobre rozpustný. Vodu považujeme za slabý elektrolyt, preto ju v iónovej rovnici nerozpisujeme:
2H+ + SO42- + 2Na+ + 2OH- → 2Na+ + SO42- + 2H2O
Túto neutralizačnú reakciu môžeme zapísať všeobecným skráteným zápisom každej neutralizácie:
H+ + OH- → H2O
11. Vyčíslite nasledujúce iónové reakcie a dbajte aj na zachovanie celkového náboja reaktantov a produktov, nielen na stechiometriu:
P3- + H2O → PH3 + OH-
Au3+ + Cl- → [AuCl4]-
As2S3 + OH- → AsO2- + AsS2- + H2O
[Cu(H2O)6]2+ + Cl- → [CuCl4]2- + H2O
VO43- + H+ → V3O93- + H2O
CrCl2O2 + OH- → CrO42- + Cl- + H2O
HPO42- + MoO42- + H+ → [P(Mo3O10)4]3- + H2O
[Al(H2O4)(OH)2]+ + CO32- → [Al(H2O)3(OH)3] + HCO3-
Riešenie:
P3- + 3H2O → PH3 + 3OH-
Au3+ + 4Cl- → [AuCl4]-
2As2S3 + 4OH- → AsO2- + 3AsS2- + 2H2O
[Cu(H2O)6]2+ + 4Cl- → [CuCl4]2- + 6H2O
3VO43- + 6H+ → V3O93- + 3H2O
CrCl2O2 + 4OH- → CrO42- + 2Cl- + 2H2O
HPO42- + 12MoO42- + 23H+ → [P(Mo3O10)4]3- + 12H2O
[Al(H2O)4(OH)2]+ + CO32- → [Al(H2O)3(OH)3] + HCO3-