Elektrický proud v elektrolytech
1.Charakterizujte elektrický proud v elektrolytech!
Řešení:
Elektrolyty jsou látky, jejichž roztoky nebo taveniny vedou elektrický proud pomocí iontů. Elektrický proud v elektrolytech je uspořádaným pohybem kationtů (+) a aniontů (-). Kationty se pohybují na katodu (-), anionty na anodu (+). Elektrolytická disociace je proces, při kterém se neutrálně molekuly elektrlytu štěpí na ionty. Elektrolýza je proces, při kterém nastávají chemické změny elektrod a elektrolytu, pokud jím prochází elektrický proud.

2.Vypočítejte:
- a.) množství hliníku, který se vyloučí při elektrolýze na elektrodě za 24 hodin proudem 10kA.
A(Al3+) = 0,093.10-6kg.C-1
- b.) jakým proudem by se vyloučil z elektrolytu chrom s hmotností 3,24 g za 1 hodinu
A(Cr3+) = 0,18.10-6kg.C-1
Řešení:

- a.) Na elektrodě se vyloučí 80kg hliníku.
- b.) Chrom se na elektrodě vyloučí proudem 5A.
3.Určete elektrochemický ekvivalent hliníku a mědi
Řešení:
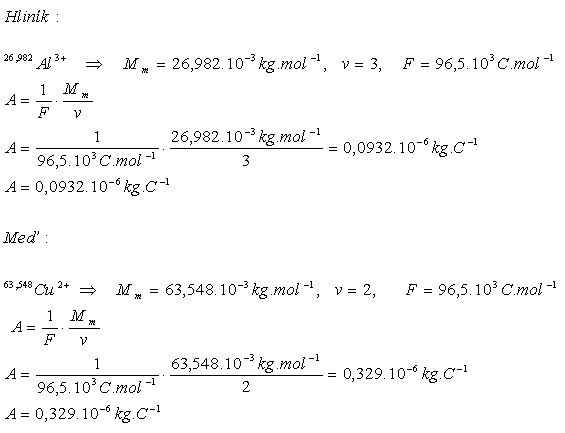
Elektrochemické ekvivalenty jsou A(Al)= 0,0932.10-6kg.C-1 a A(Cu)=0,329.10-6kg.C-1
4.Elektrolytem CuSO4 prochází proud 1A. Kolik atomů mědi se vyloučí na katodě za 10 sekund?
A(Cu) = 0,329.10-6kg.C-1 NA = 6,022.1023mol-1, Mm = 63,548.10-6kg.mol-1
Řešení:
Rozbor:
I = 1A, t = 10s, A(Cu) = 0,329.10-6kg.C-1 NA = 6,022.1023mol-1, Mm = 63,548.10-6kg.mol-1
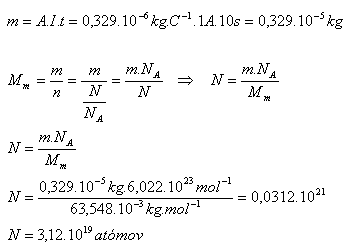
Na katodě se vyloučí N = 3,12.1019 atomů mědi.
5. Koule, jejíž poloměr je r = 5cm, má být poniklovaná vrstvou tloušťky h = 0,15 mm. Jak dlouho třeba kouli ponechat v elektrolytu při proudu I = 1A?
Řešení:
Rozbor:
r = 5cm = 5.10-2m, h = 0,15.10-3m, I = 1A, A(Ni) = 0,304.10–6kg.C–1, ρ(Ni) = 8,8.103kg.m–3
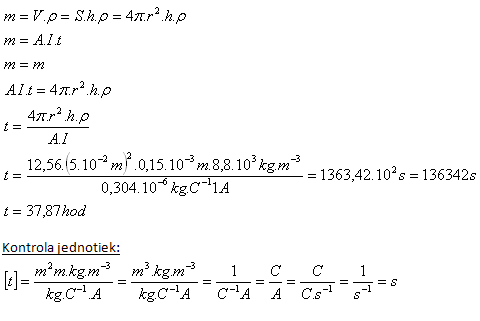
Poniklování koule trvá asi 38 hodin.
6.Poniklování kovové destičky, která má povrch 100cm2, trvalo při proudu 0,4 A čtyři hodiny. Vypočtěte tloušťku niklové vrstvy, která se na destičce vytvořila!
Řešení:
Rozbor:
S = 100cm2 = 10–2m2, I = 0,4A, t = 4hod = 14 400s, v = 2, F = 96,5.103C.mol-1,
Mm(Ni) = 58,7.10–3kg.mol–1, ρ(Ni) = 8,9.103kg.m–3
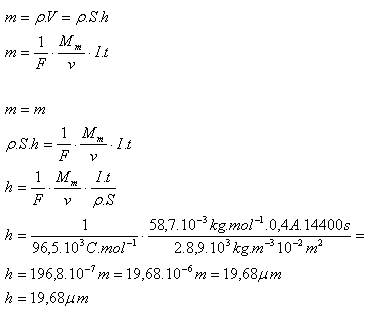
Tloušťka niklové vrstvy je h = 19,68 mikrometrů.
7.Jakou energii potřebujeme, abychom při elektrolýze síranu měďnatého CuSO4 získali měď o hmotnosti 1g, pokud elektrolýza probíhá při napětí 4V?
Řešení:
Rozbor:
m = 1g = 10–3kg, U = 4V, A(Cu) = 0,329.10–6kg.C–1
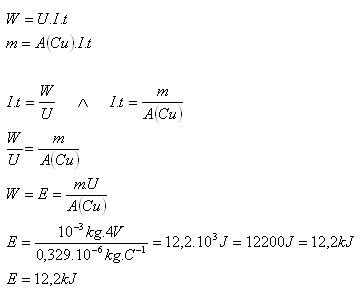
Při elektrolýze spotřebujeme 12,2 kJ energie.
8.Dvě elektrolytické vany s roztoky AgNO3 a CuSO4 jsou zapojeny sériově. Kolik mědi se vyloučí za dobu, za kterou se vyloučí 850 mg stříbra?
Řešení:
Rozbor:
A(Ag) = 1,118.10–6kg.C–1, A(Cu) = 0,329.10–6kg.C–1, mAg = 850mg. mCu = ?
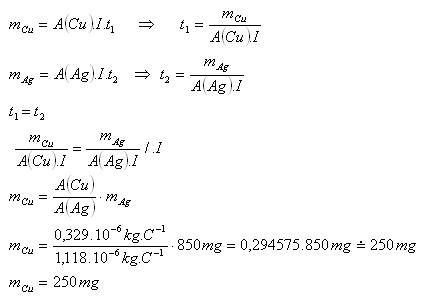
Vyloučí se 250 mg mědi.
9.Jaký elektrický proud procházel elektrolytem, když měděná katoda vážila před měřením 35g a po měření, které trvalo 40 minut 39g.
Řešení:
Rozbor:
Δm = 4g = 4.10-3kg, t = 40min = 2400s, A(Cu) = 0,329.10–6kg.C–1
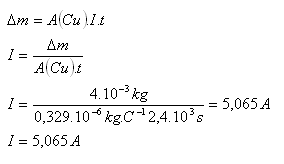
Elektrolytem procházel proud I = 5,065 A.
10.Rozkladné napětí při elektrolýze kyseliny sírové mělo hodnotu 2,2 V. Při napětí 3,5 V procházel elektrolytem proud 2,8 A. Elektrody byly od sebe vzdáleny 4cm a průřez elektrolytického vodiče byl 30cm2. Určitě měrný odpor (odpor) elektrolytu!
Řešení:
Rozbor:
Ur = 2,2V, U = 3,5V, I = 2,8A, S = 30.10–4m2, l = 4cm = 4.10–2m, ρ = ?
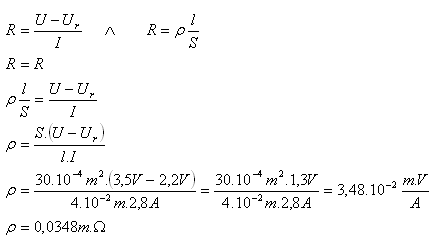
Měrný odpor (rezistivita) elektrolytu je ρ = 0,0348 m.Ώ.
11.Za jaký čas se vyloučí z roztoku CuSO4 měď s hmotností 1,778 g proudem 3A?
Řešení:
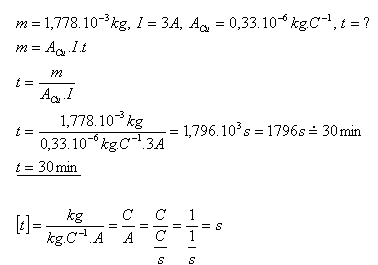
Měď se z roztoku CuSO4 vyloučí za asi 30 minut.
12.Při elektrolýze modré skalice CuSO4 se na katodě za 2 hodiny vyloučí dvojmocných měď s hmotností
m = 9,504 g, Ampérmetr ukázal proud IA = 4,1 A. Zjistěte chybu ampérmetru ΔI.
Řešení:
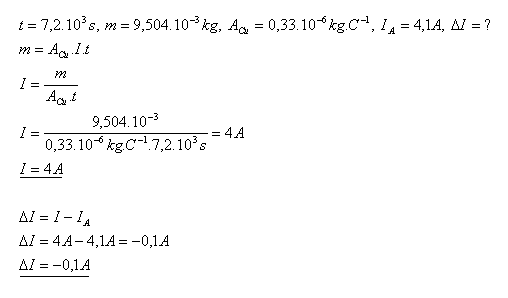
Chyba ampérmetru je ΔI = –0,1A.
13.Dvě elektrolytické nádoby s roztoky AgNO3 a CuSO4 jsou sériově spojeny. Určitě hmotnost mědi, která se při elektrolýze vyloučí za čas, za který se v druhé nádobě vyloučilo stříbro s hmotností 180g.
Řešení:
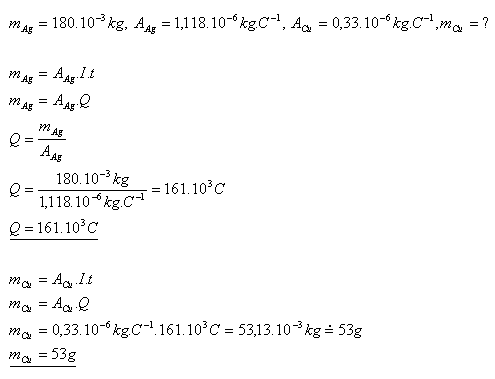
Při elektrolýze se vyloučí asi 53 gramů mědi.
14.Při elektrolýze ZnSO4 se za 1 hodinu vyloučí zinek s hmotností m = 2,45 g. Určitě elektrický odpor roztoku, pokud napětí ně elektrodách bylo U = 6V.
Řešení:
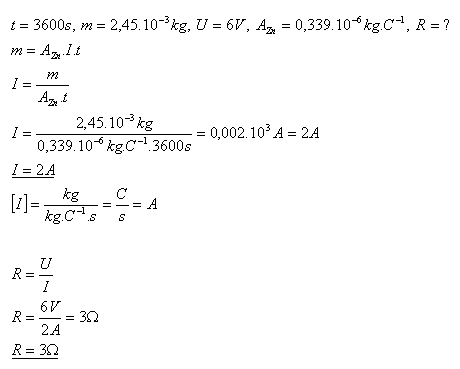
Elektrický odpor roztoku je R = 3Ώ.
15.Předmět s povrchem S = 20 dm2 je třeba postříbřit vrstvou o tloušťce h = 0,2 mm. Jak dlouho bude trvat pokovování, pokud 1 dm2 plochy může být zatížen proudem I = 0,4 A?
Řešení:
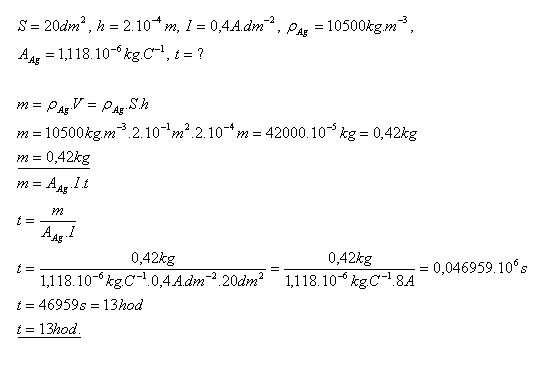
Pokovování předmětu bude trvat asi 13 hodin.
16.Jakou energii potřebujeme, abychom při elektrolýze síranu měďnatého CuSO4 získali měď o hmotnosti
m = 1g, pokud elektrolýza proběhla při napětí U = 4V.
Řešení:
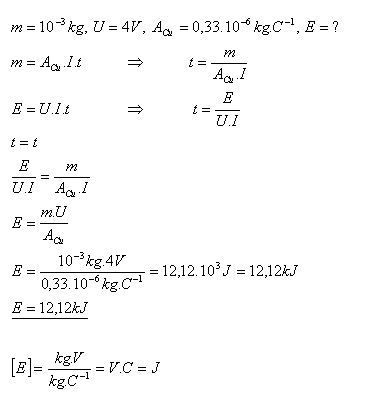
Při elektrolýze síranu měďnatého potřebujeme energii E = 12,12 kJ.
17.Roztokem CuSO4 prochází proud I = 1A. Kolik atomů mědi se vyloučí na katodě za t = 1s? (z = 2)
Řešení:
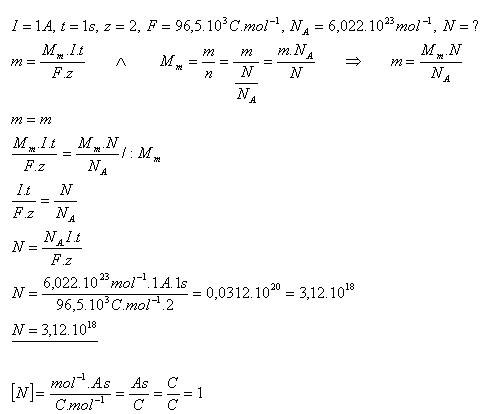
Na katodě se za 1 sekundu vyloučí 3,12.1018 atomů mědi.
18. Jaký je elektrický náboj jednoho Iona stříbra, které se vyloučí elektrolýzou dusičnanu stříbrného nábojem Q = 1C.
Řešení:
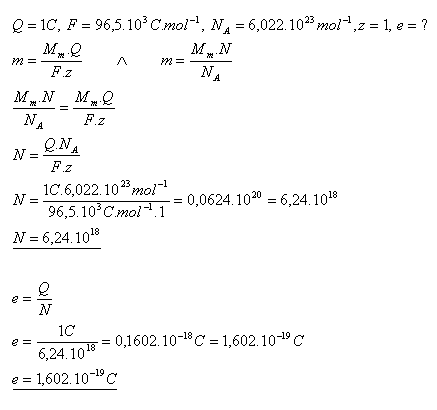
Náboj jednoho iontu stříbra je e = 1,602.10–19C
19. Kolik a.) Stříbra b.) Dvojmocné mědi se vyloučí z příslušných roztoků pokud jimi projde náboj Q = 96,5.106C?
Řešení:

Z příslušných roztoků se nábojem Q vyloučí 107,88 kg stříbra a 31,75 kg mědi.
20.Akumulátor se nabíjel proudem I1 = 5A po dobu t1 = 6 hodin. Jak dlouho se vybíjel, jestliže se při vybíjení odebíral z akumulátoru stálý proud I2 = 0,05 A. Nábojová účinnost akumulátoru je η = 90%.
Řešení:
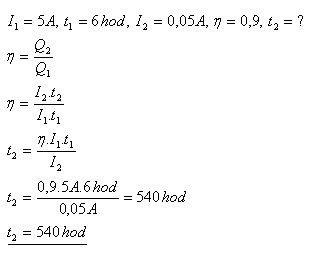
Akumulátor se vybíjel 540 hodin.