Elektrický prúd v elektrolytoch
1.Charakterizujte elektrický prúd v elektrolytoch!
Riešenie:
Elektrolyty sú látky, ktorých roztoky alebo taveniny vedú elektrický prúd pomocou iónov. Elektrický prúd v elektrolytoch je usporiadaným pohybom katiónov (+) a aniónov (-). Katióny sa pohybujú na katódu (-), anióny na anódu (+). Elektrolytická disociácia je proces, pri ktorom sa neutrálne molekuly elektrlytu štiepia na ióny. Elektrolýza je proces, pri ktorom nastávajú chemické zmeny elektród a elektrolytu, ak ním prechádza elektrický prúd.

2.Vypočítajte:
- a.) množstvo hliníka, ktorý sa vylúči pri elektrolýze na elektróde za 24 hodín prúdom 10kA.
A(Al3+) = 0,093.10-6kg.C-1
- b.) akým prúdom by sa vylúčil z elektrolytu chróm s hmotnosťou 3,24g za 1hodinu.
A(Cr3+) = 0,18.10-6kg.C-1
Riešenie:

- a.) Na elektróde sa vylúči 80kg hliníka.
- b.) Chróm sa na elektróde vylúči prúdom 5A.
3.Určite elektrochemický ekvivalent hliníka a medi
Riešenie:
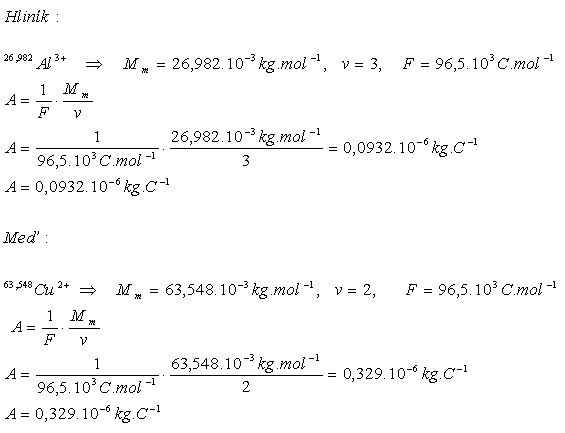
Elektrochemické ekvivalenty sú A(Al)= 0,0932.10-6kg.C-1 a A(Cu)=0,329.10-6kg.C-1
4.Elektrolytom CuSO4 prechádza prúd 1A. Koľko atómov medi sa vylúči na katóde za 10 sekúnd? A(Cu) = 0,329.10-6kg.C-1 NA = 6,022.1023mol-1, Mm = 63,548.10-6kg.mol-1
Riešenie:
Rozbor:
I = 1A, t = 10s, A(Cu) = 0,329.10-6kg.C-1 NA = 6,022.1023mol-1, Mm = 63,548.10-6kg.mol-1
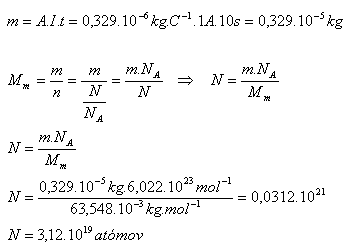
Na katóde sa vylúči N = 3,12.1019 atómov medi.
5. Guľa, ktorej polomer je r = 5cm, má byť poniklovaná vrstvou hrúbky h = 0,15mm. Ako dlho treba guľu ponechať v elektrolyte pri prúde I = 1A?
Riešenie:
Rozbor:
r = 5cm = 5.10-2m, h = 0,15.10-3m, I = 1A, A(Ni) = 0,304.10–6kg.C–1, ρ(Ni) = 8,8.103kg.m–3
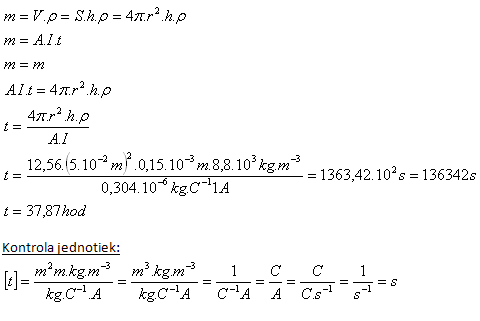
Poniklovanie gule trvá asi 38 hodín.
6.Poniklovanie kovovej doštičky, ktorá má povrch 100cm2, trvalo pri prúde 0,4A štyri hodiny. Vypočítajte hrúbku niklovej vrstvy, ktorá sa na doštičke vytvorila!
Riešenie:
Rozbor:
S = 100cm2 = 10–2m2, I = 0,4A, t = 4hod = 14 400s, v = 2, F = 96,5.103C.mol-1,
Mm(Ni) = 58,7.10–3kg.mol–1, ρ(Ni) = 8,9.103kg.m–3
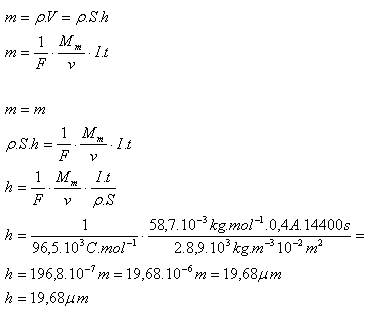
Hrúbka niklovej vrstvy je h = 19,68μm.
7.Akú energiu potrebujeme, aby sme pri elektrolýze síranu meďnatého CuSO4 získali meď o hmotnosti 1g, ak elektrolýza prebieha pri napätí 4V?
Riešenie:
Rozbor:
m = 1g = 10–3kg, U = 4V, A(Cu) = 0,329.10–6kg.C–1
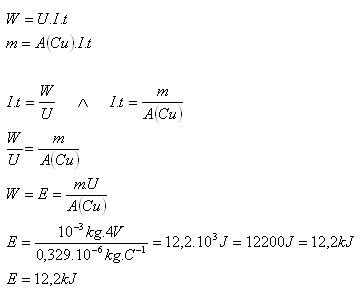
Pri elektrolýze spotrebujeme 12,2 kJ energie.
8.Dve elektrolytické vane s roztokmi AgNO3 a CuSO4 sú zapojené sériovo. Koľko medi sa vylúči za dobu, za ktorú sa vylúči 850 mg striebra?
Riešenie:
Rozbor:
A(Ag) = 1,118.10–6kg.C–1, A(Cu) = 0,329.10–6kg.C–1, mAg = 850mg. mCu = ?
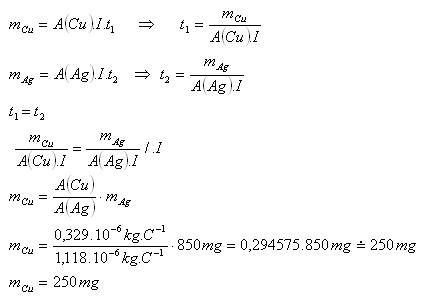
Vylúči sa 250 mg medi.
9.Aký elektrický prúd prechádzal elektrolytom, keď medená katóda vážila pred meraním 35g a po meraní, ktoré trvalo 40 minút 39g.
Riešenie:
Rozbor:
Δm = 4g = 4.10-3kg, t = 40min = 2400s, A(Cu) = 0,329.10–6kg.C–1
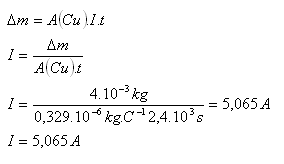
Elektrolytom prechádzal prúd I = 5,065A.
10.Rozkladné napätie pri elektrolýze kyseliny sírovej malo hodnotu 2,2V. Pri napätí 3,5V prechádzal elektrolytom prúd 2,8A. Elektródy boli od seba vzdialené 4cm a prierez elektrolytického vodiča bol 30cm2. Určite merný odpor (rezistivitu) elektrolytu!
Riešenie:
Rozbor:
Ur = 2,2V, U = 3,5V, I = 2,8A, S = 30.10–4m2, l = 4cm = 4.10–2m, ρ = ?
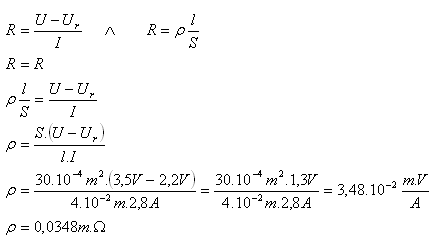
Merný odpor (rezistivita) elektrolytu je ρ = 0,0348m.Ώ.
11.Za aký čas sa vylúči z roztoku CuSO4 meď s hmotnosťou 1,778g prúdom 3A?
Riešenie:
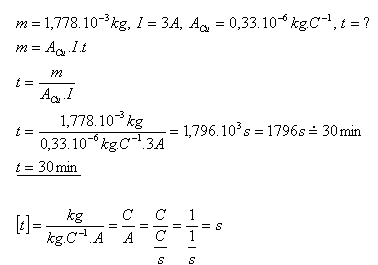
Meď sa z roztoku CuSO4 vylúči za asi 30 minút.
12.Pri elektrolýze modrej skalice CuSO4 sa na katóde za 2 hodiny vylúči dvojmocná meď s hmotnosťou m = 9,504g, Ampérmeter ukázal prúd IA = 4,1A. Zistite chybu ampérmetra ΔI.
Riešenie:
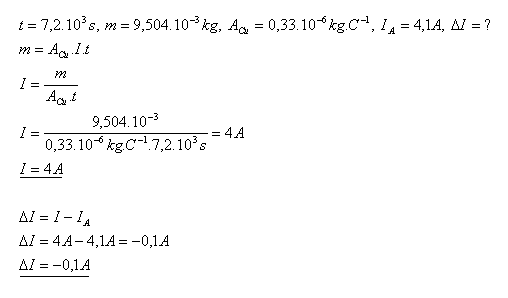
Chyba ampérmetra je ΔI = –0,1A.
13.Dve elektrolytické nádoby s roztokmi AgNO3 a CuSO4 sú sériovo spojené. Určite hmotnosť medi, ktorá sa pri elektrolýze vylúči za čas, za ktorý sa v druhej nádobe vylúčilo striebro s hmotnosťou 180g.
Riešenie:
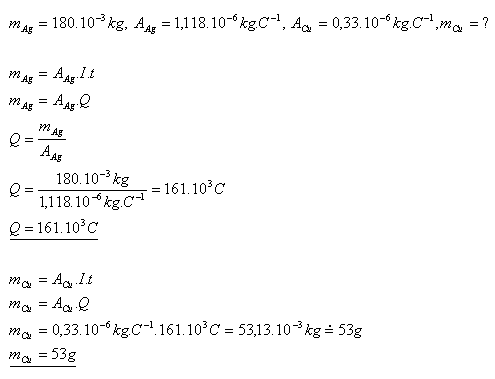
Pri elektrolýze sa vylúči asi 53 gramov medi.
14.Pri elektrolýze ZnSO4 sa za 1 hodinu vylúči zinok s hmotnosťou m = 2,45g. Určite elektrický odpor roztoku, ak napätie ne elektródach bolo U = 6V.
Riešenie:
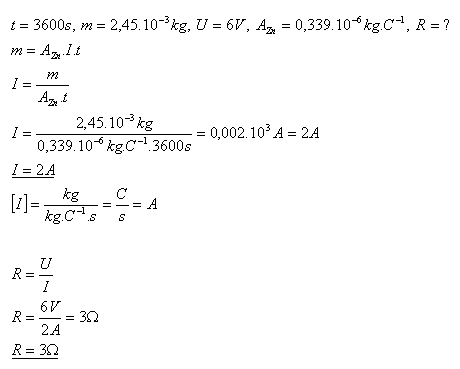
Elektrický odpor roztoku je R = 3Ώ.
15.Predmet s povrchom S = 20 dm2 je treba postriebriť vrstvou o hrúbke h = 0,2mm. Ako dlho bude trvať pokovovanie, ak 1 dm2 plochy môže byť zaťažený prúdom I = 0,4A?
Riešenie:
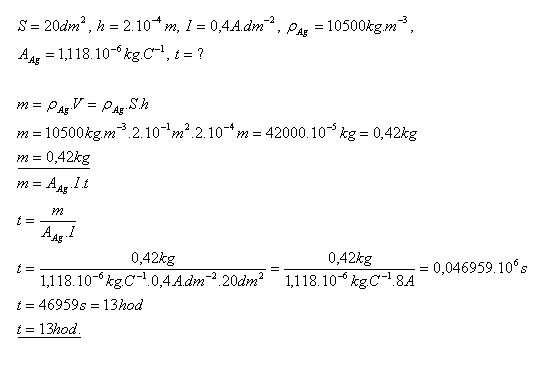
Pokovovanie predmetu bude trvať asi 13 hodín.
16.Akú energiu potrebujeme, aby sme pri elektrolýze síranu meďnatého CuSO4 získali meď o hmotnosti m = 1g, ak elektrolýza prebehla pri napätí U = 4V.
Riešenie:
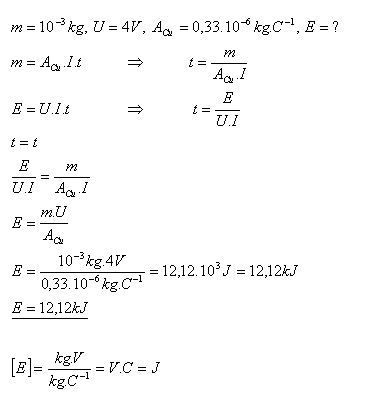
Pri elektrolýze síranu meďnatého potrebujeme energiu E = 12,12 kJ.
17.Roztokom CuSO4 prechádza prúd I = 1A. Koľko atómov medi sa vylúči na katóde za t = 1s? (z = 2)
Riešenie:
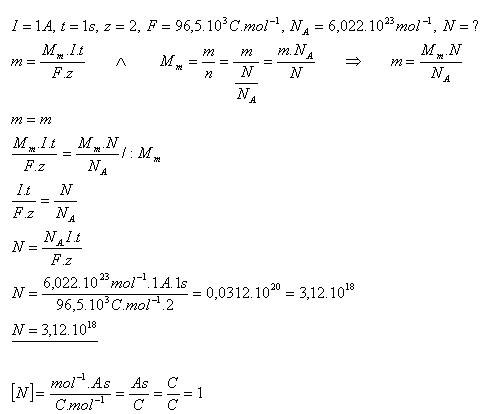
Na katóde sa za 1 sekundu vylúči 3,12.1018 atómov medi.
18. Aký je elektrický náboj jedného ióna striebra, ktoré sa vylúči elektrolýzou dusičnanu strieborného nábojom Q = 1C.
Riešenie:
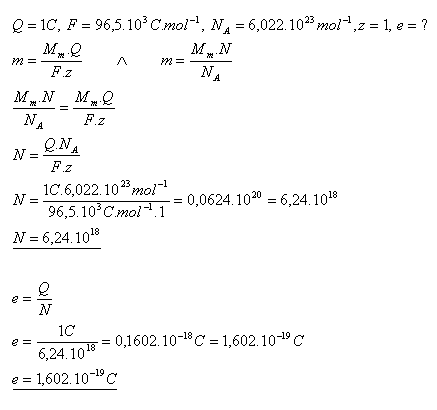
Náboj jedného iónu striebra je e = 1,602.10–19C
19. Koľko a.) striebra b.) dvojmocnej medi sa vylúči z príslušných roztokov ak nimi prejde náboj Q = 96,5.106C?
Riešenie:

Z príslušných roztokov sa nábojom Q vylúči 107,88 kg striebra a 31,75 kg medi.
20.Akumulátor sa nabíjal prúdom I1 = 5A po dobu t1 = 6 hodín. Ako dlho sa vybíjal, ak sa pri vybíjaní odoberal z akumulátora stály prúd I2 = 0,05A. Nábojová účinnosť akumulátora je η = 90%.
Riešenie:
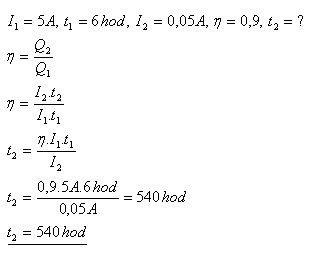
Akumulátor sa vybíjal 540 hodín.