Výpočet zlomku a percenta prvku v zlúčenine
1.V nádobe sa nachádza zmes plynov obsahujúca 0,825 mol oxidu siričitého, 4,29 mol dusíka, 0,055 mol argónu a 0,33 mol kyslíka. Vypočítajte molové zlomky jednotlivých zložiek v sústave.
Riešenie:
Ako prvé vypočítame celkové látkové množstvo plynnej zmesi:
n = (0,825 + 4,29 + 0,055 + 0,33) mol = 5,50 mol
Molové zlomky zložiek vypočítame nasledovne:
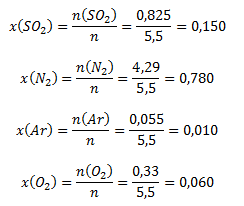
Molové zlomky plynov v zmesi sú 0,15 (SO2); 0,78 (N2); 0,01 (Ar); 0,06 (O2).
2. Vypočítajte:
- a) hmotnostný zlomok a percentuálny obsah síry a železa v pyrite
- b) koľko g síry obsahuje 500 g pyritu
Riešenie:
a) Hmotnostný zlomok síry v pyrite vypočítame podľa vzťahu:
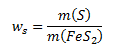
Tento výraz upravíme tak, aby obsahoval molové hmotnosti (zistíme ich z tabuliek) a látkové množstvá síry a pyritu. Hmotnosti daných látok vyjadríme preto ako:
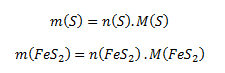
Po dosadení týchto vzťahov do rovnice pre hmotnostný zlomok dostávame:
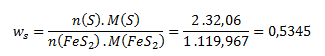
Vypočítanému hmotnostnému zlomku síry zodpovedá hmotnostné percento podľa vzťahu:
hmotnostné percento= ws.100= 0,5345 . 100 = 53,45 %
Hmotnostný zlomok druhej zložky pyritu, železa, dopočítame nasledovne:
wFe= 1 – 0,5345 = 0,4655
hmotnostné percento = 0,4655 . 100 = 46,55 %
3.Koľko percent dusíka obsahuje dusičnan vápenatý Ca(NO3)2?
Riešenie:
Mólová hmotnosť dusičnanu je 164,086 g.mol-1. Relatívna atómová hmotnosť dusíka je 14,007. Logicky sa v 164,086 gramoch zlúčeniny nachádza 14,007 g dusíka. Pre zistenie percentuálneho obsahu je potrebné dať do pomeru hmotnosť dusíka a zlúčeniny:
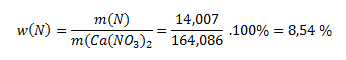
Dusík sa však v prírode vyskytuje ako dimér, N2, preto je percentuálny obsah N2 dvojnásobný než obsah N, správna odpoveď je teda 17,07 %.
4.25 cm3 glycerolu sa rozpustilo v 100 cm3 vody. Vypočítajte hmotnostný zlomok glycerolu v roztoku a vyjadrite ho v hmotnostných percentách. Hustota glycerolu je pri teplote 20°C 1,261 g.cm-3.
Riešenie:
Hmotnosť glycerolu vypočítame zo vzťahu:
m = ρ .V = 1,261 .25 = 31,5 g
Hmotnosť roztoku vypočítame ako súčet glycerolu a vody:
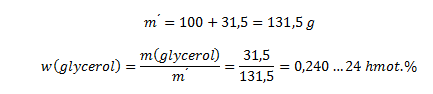
Roztok obsahuje 24 hmotnostných percent glycerolu.
5.Pri teplote 25°C a tlaku 101,5 kPa sa zmiešali 15,5 dm3 vodíka H2 a 10 dm3 neónu Ne. Zloženie plynnej zmesi vyjadrite:
- a) v objemových percentách
- b) v molových percentách
Riešenie:
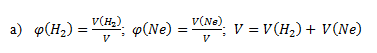
Po dosadení známych hodnôt dostaneme:
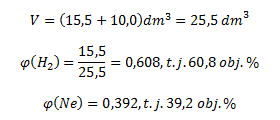
Plynná zmes obsahuje 60,8 obj.% vodíka a 39,2 obj.% neónu.
b) Látkové množstvo neónu a vodíka vypočítame zo stavovej rovnice:
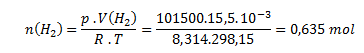
Neón vypočítame obdobne:
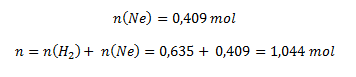
potom:
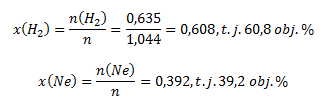
Z riešenia v bode a) a b) vidieť, že φi=xi. Toto platí pre plyny, ktorých objemy sa merali za rovnakých stavových podmienok.
6.Alkoholicý nápoj obsahuje 40 obj% etanolu. Vypočítajte objem čistého etanolu a vody v 750 cm3 tohto nápoja.
Riešenie:
Vychádzame zo vzťahu:
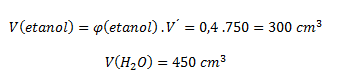
Nápoj obsahuje 300 cm3 etanolu a 450 cm3 vody.
7.Koľko gramov bezvodého síranu meďnatého obsahuje 12g jeho pentahydrátu, ktorého čistota je 98,2 %?
Riešenie:
Pretože pomer mólových hmotností bezvodej soli a jeho pentahydrátu je konštantný, pre čisté látky s hmotnosťou m platí:
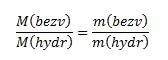
z toho hmotnosť bezvodého síranu meďnatého:
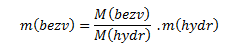
Keďže v našom prípade hydrát nie je čistá látka, ale zmes obsahujúca 98,2% CuSO4.5H2O, m(hydr) si vyjadríme pomocou vzťahu:
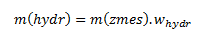
Dosadením do vzťahu dostaneme:
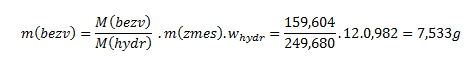
12g modrej skalice so zadanou čistotou obsahuje 7,533 g CuSO4.
8.Koľko percent síry obsahuje oxid sírový?
Riešenie:
Mólová hmotnosť SO3 je 80,062 g.mol-1, mólová hmotnosť síry je 32,065 g.mol-1. Logickou úvahou sa dopracujeme k:
80,062g oxidu predstavuje ..............100%
32,065 g síry predstavuje .................x%
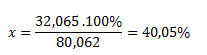
Oxid sírový obsahuje 40,05% síry.
9.Koľko % hmotnosti stratí zelená skalica FeSO4.7H20 vypálením na vysokú teplotu(čím stratí všetku svoju kryštálovú vodu)?
Riešenie:
Mólová hmotnosť heptahydrátu síranu železnatého je 278,05 g.mol-1, mólová hmotnosť bezvodého síranu je 151,908. Po vypálení heptahydrátu ostane čistý bezvodý síran, takže došlo k strate siedmich mol vody, čo prestavuje (7.18)g.mol-1=126g.mol-1.
Logicky, 278,05 gramov heptahydrátu stratilo 126 gramov vody, čo predstavuje:
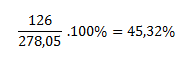
Žíhaním zelenej skalice dôjde k strate 45,32 % pôvodnej hmotnosti skalice.
10.Vypočítajte hmotnosť nasýteného roztoku dichrómanu didraselného pri teplote 50°C, ktorý sa pripravil z 10 g čistého dichrómanu. Pri teplote 50°C sa rozpustí 34,5g K2Cr2O7 v 100g vody.
Riešenie:
Vychádzame z upraveného vzorca pre hmotnostný zlomok:
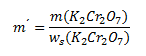
ws (K2Cr2O7) je hmotnostný zlomok K2Cr2O7v nasýtenom roztoku, ktorý vypočítame z uvedenej rozpustnosti K2Cr2O7:
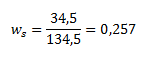
Zistené hodnoty dosadíme:
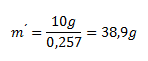
Z 10 g K2Cr2O7 sa pripravilo 38,9 g roztoku K2Cr2O7 nasýteného pri teplote 50°C.