Látkové charakteristiky
1.Které fyzikální veličiny charakterizují látku?
Řešení:

2.Určete klidové hmotnosti atomů prvků H, C, Zn. Jaká je relativní hmotnost Uranu, pokud jeho klidová hmotnost je ma (U) = 3,95.10-25kg. Využijte tabulky.
Řešení:
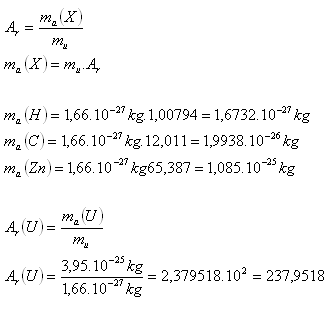
Relativní hmotnost Uranu je asi Ar(U) =238
3.Určete přibližný počet atomů, které jsou obsaženy v železném závaží o hmotnosti 1 kg. Jaký dlouhá řada by vznikl seřazením všech těchto atomů těsně vedle sebe do jedné přímky. Průměr atomu je asi 10-10m.
Řešení:
Rozbor:
m = 1 kg, d = 10-10m, mu = 1,66.10-27kg, Ar(Fe) = 55,847
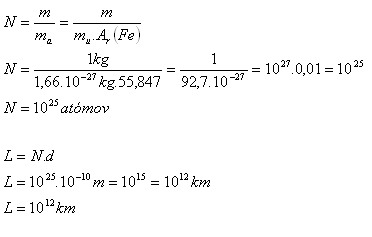
V jednom kilogramu železa je 1025 atomů. Délka řady sestaveného z těchto atomů by byla 1012km. Je to délka asi 6600 krát větší než vzdálenost Země - Slunce.
4. Určete počet elektronů, které jsou obsaženy v mědi s hmotností 1g. Jaká je jejich celková hmotnost, pokud hmotnost jednoho elektronu je 9,1.10-31kg?
Řešení:
Rozbor:
m = 1g = 10-3kg, me = 9,1.10-31kg, mu = 1,66.10-27kg, Ar (29Cu) = 63,546
Klidová hmotnost atomu Cu:
ma (Cu) = mu.Ar(Cu)
ma (Cu) = 1,66.10-27kg.63,546 = 105,486.10-27kg
Počet molekul:
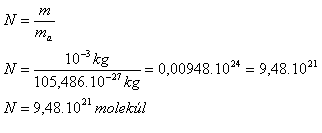
Počet elektronů:
29Cu – každá molekula má 29 elektronů
N‘ = 29.N = 29.9,48.1021 = 2,75.1023
Hmotnost všech elektronů:
m = N‘.me = 2,75.1023. 9,1.10-31kg = 25.10-8kg
V jednom gramu mědi je 2,75.1023 elektronů, které mají hmotnost 25.10-8kg.
5.Zjistěte, zda molekula kyseliny dusičné HNO3 má větší hmotnost než molekula oxidu stříbrného Ag2O. Použijte tabulky.
Řešení:
HNO3
Ar(H) = 1,008
Ar(N) = 14,010
3.Ar(O)= 48,000
Ar (HNO3) = 63,018 m(HNO3) = 63,048.1,66.10-27kg
m(HNO3) = 1, 46.10-25kg
Ag2O
2.Ar(Ag) = 215,74
Ar(O) = 16,00
Ar(Ag2O)= 231,74 m(Ag2O) = 231,74.1,66.10-27kg
m(Ag2O) = 3,8469.10-25kg
m(Ag2O) > m(HNO3)
Předpoklad neplatí.
6.Vypočítejte, jaké látkové množství představuje 4,82.1024 atomů vodíku.
Řešení:
Rozbor:
N = 4,82.1024 atomů vodíku, NA= 6,022.1023mol-1
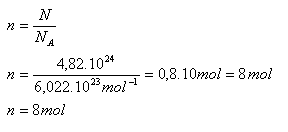
Dané množství atomů vodíku představuje n = 8 molů.
7.Určete látkové množství vody s objemem 3,6 l.
Řešení:
Rozbor:
V = 3,6 l, m = 3,6 kg,
2Ar(H) = 2, 016
Ar(O) = 16,000
Ar(H2O) = 18,016
Mm = 18,016.10-3kg.mol-1
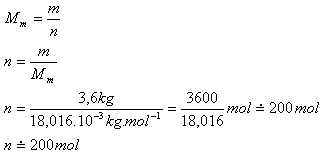
Objem 3,6 litrů vody je 200 molů.
8.Zjistěte, zda lze nalít do válce o objemu 10 cm3 vodu s látkovým množstvím 1 mol.
Řešení:
Rozbor:
n = 1 mol, V = 10 cm3, mM = 18,016.10-3 kg, (príklad 7), ρ = 103 kg.m-3
Objem jedného molu vody:
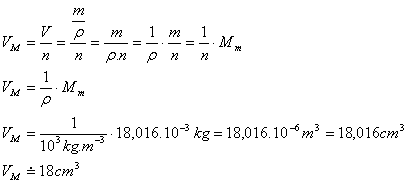
Objem valca VV = 10 cm3
VM > VV
Vodu do válce nelze nalít, neboť objem jednoho molu vody je 18 cm3 a nádoby len 10 cm3.
9.Místnost má rozměry a = 4m, b = 4m, c = 3m. Kolik je v ní molekul vzduchu? (Mm = 29.10-3kg.mol-1, ρ = 1,276kg.m-3)
Řešení:
Rozbor:
V = a.b.c
V =4m.4m.3m = 48 m3,
Mm = 29.10-3kg.mol-1, ρ = 1,276kg.m-3
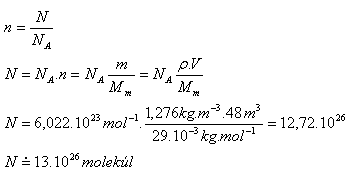
V místnosti je asi 13.1026molekúl.
10. Z povrchu vodní kapky o objemu 1 mm3 se za 1 sekundu vypaří voda obsahující asi 1016 molekul. Za jaký čas se vypaří celá kapka?
Řešení:
Rozbor:
V = 1mm3 = 10-9m3, N‘ = 1016s-1, Mm(H2O) = 18,016.10-3kg.mol-1
ρ = 1000 kg.m-3, NA = 6,022.1023mol-1
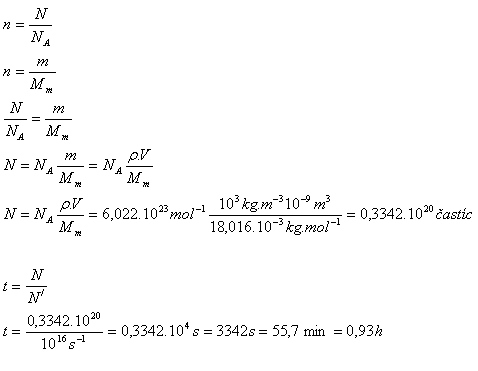
Celá kapka se vypaří za necelou 1 hodinu.
11. Určete relativní molekulovou hmotnost oxidu uhličitého CO2 klidovou hmotnost molekuly CO2. Použijte tabulky. (mu = 1,6605.10-27kg)
Řešení:
1.) Mr( CO2) = 1C = 1.12,01 = 12,01
2O = 2.15,999 = 31,998
Mr( CO2) = 12,01+31,998 = 44,008 = 44,01
Mr( CO2) = 44,01
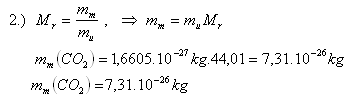
12. V uzavřené nádobě umístěné ve vakuu je plynný oxid uhličitý o hmotnosti 1,1 kg. Z nádoby uniká za 1 sekundu průměrně N '= 1,5.1020 molekul. Za jaký čas uniknou z nádoby všechny molekuly CO2.
Řešení:
Rozbor:
m = 1,1 kg, Mr( CO2) = 44,01, N‘ = 1,5.1020, N = ?, t = ?
1.) Počet všech molekul v nádobě na začátku pokusu:
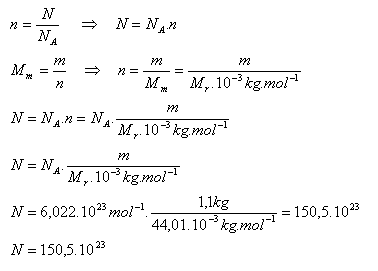
2.) Čas za který uniknou z nádoby všechny molekuly:
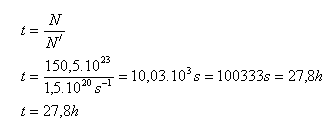
Všechny molekuly CO2 uniknou z nádoby za asi 28 hodin.
13.Vypočtěte molární objem olova.
Řešení:
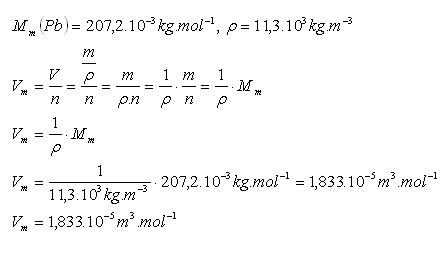
Molární objem olova je Vm = 1,833.10–5m3.mol–1.
14. Průměr molekuly kyslíku O2 je 0,364 nm. Jak dlouhý by byl řadu, který by vznikl těsným seřazením všech molekul, které jsou obsaženy v jednom mole kyslíku.
Řešení:
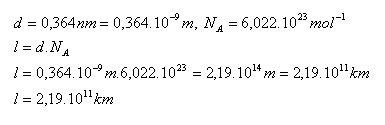
Řada by byla dlouhá 2,19.1011 km
15.V nádobě s objemem 2 litry se nachází 2,74.1019 molekul chlóru Cl2. Vypočtěte hustotu molekul NV tohoto plynu.
Řešení:
Rozbor:
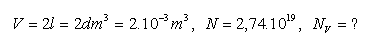
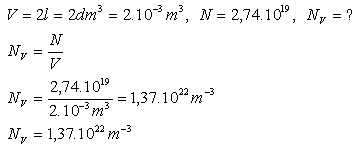
Hustota molekul chloru je je NV=1,37.1022m-3
16.Vypočtěte střední kvadratickou rychlost vk molekuly chloru Cl2 při teplotě 1000C.
Řešení:
Rozbor:
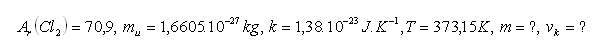
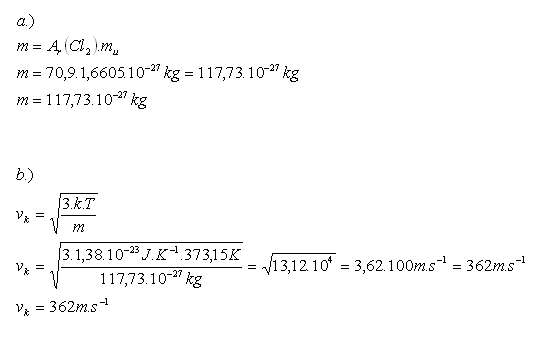
Střední kvadratická rychlost molekuly chloru je vk=362m.s-1
17.Vypočtěte střední kinetickou energii jedné molekuly ideálního plynu při teplotě t = -200C.
(k = 1,38.10-23J.K-1)
Řešení:
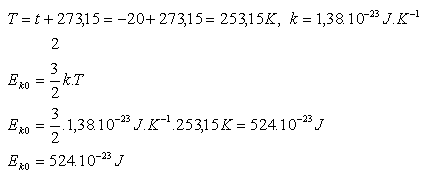
18.Zjistěte průměr molekuly vody H2O.
Řešení:
Rozbor:
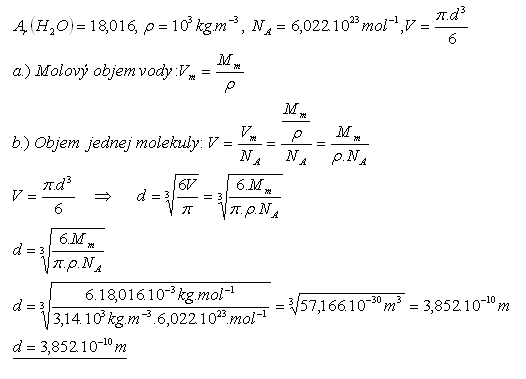
Průměr molekuly vody je 3,852.10–10m.
19. Vzorek kyslíku O2 o hmotnosti 5 kg má pri teplotě00C a tlaku 0,1 MPa objem 3,54 m3. Určete molární objem kyslíku.
Řešení:
Rozbor:
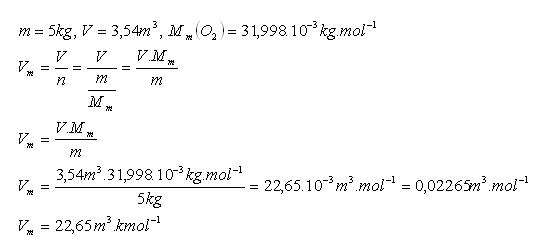
Molární objem kyslíku O2 je Vm = 22,65 m3.kmol-1.
20.Vypočtěte jaký počet molekul obsahuje vodík H2 s látkovým množstvím n1 = 10 mol a kyselina olejová C17H33COOH se stejným látkovým množstvím n2 = 10 mol.
Řešení:
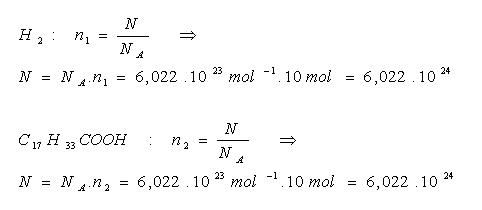
Ve stejných látkových množstvích (n1 = n2) je vždy stejný počet molekul.