Hustota látky
1.Vypočítajte hustotu dusíka v g.dm-3 za normálnych podmienok.
Riešenie:
Do vzťahu pre výpočet hustoty zo stavovej rovnice dosadíme hodnoty zo zadania a z tabuliek
Ar (N)=14,01
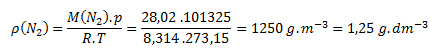
Hustota dusíka N2 za normálnych podmienok je 1,25 g.dm-3.
2.Vypočítajte hustotu ortuti v g.cm-3 pri 20°C, ak molový objem ortuti pri tejto teplote je 0,0148 dm3.mol-1.
Riešenie:
V tabuľkách vyhľadáme M(Hg) = 200,59 g.mol-1. Hodnoty dosadíme do vzorca:
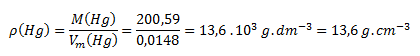
Hustota ortuti pri teplote 20°C je 13,6 g.cm-3.
3.Určte molárnu hmotnosť plynu, ktorý má za normálnych podmienok hustotu 1,429 kg.m-3.
Riešenie:
Z údaju o hustote vieme logicky vyvodiť, že 1000 litrov plynu má hmotnosť 1,429 kg. Za normálnych podmienok 1 mol plynu zaberá 22,41 litra.
1000 l plynu.......................1,429 kg
22,41 l plynu......................x kg
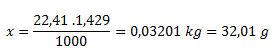
Molárna hmotnosť neznámeho plynu je 32,01 g.mol-1, z tabuliek vieme odčítať že sa jedná o kyslík.
4.Meraním sa zistilo, že hustota neznámeho plynného nasýteného uhľovodíka je za tých istých experimentálnych podmienok (tlak a teplota) 21,88 ráz vyššia než hustota vodíka. Vypočítajte molovú hmotnosť uhľovodíka a podľa tabuliek určte neznámy uhľovodík.
Riešenie:
Pre hustotu plynného uhľovodíka CxHy a vodíka platia vzťahy:
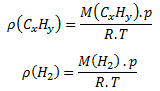
Vydelením týchto dvoch rovníc dostaneme:
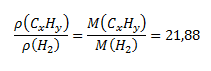
Z toho:
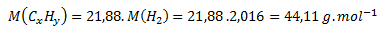
Mólová hmotnosť neznámeho plynného uhľovodíka je 44,11 g.mol-1. Táto hodnota zodpovedá trom uhlíkom a ôsmim vodíkom, čiže propánu C3H8.
5.Vypočítajte hustotu v kg.m-3
- a) kyslíka O2 za normálnych podmienok
- b) ozónu O3 za normálnych podmienok
Riešenie:
a) Hodnoty z tabuliek M(O2)= 31,998 g.mol-1 dosadíme do vzorca:
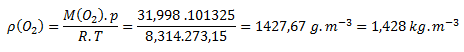
Hustota kyslíka je za normálnych podmienok 1,428 kg.m-3.
b) Obdobne postupujeme aj pri ozóne, M(O3) = 47,997g.mol-1
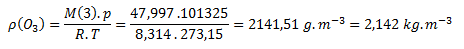
Hustota ozónu je za normálnych podmienok 2,142 kg.m-3.
6.1 m3 dusíka má za normálnych podmienok hmotnosť 1,25 kg. Pri akej teplote a konštantnom tlaku bude hustota dusíka polovičná?
Riešenie:
Pre východiskový stav plynu platí:
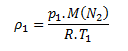
V konečnom stave má hustotu:
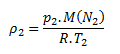
Pretože p1=p2, pre pomer obidvoch hustôt platí:
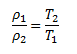
Z toho:
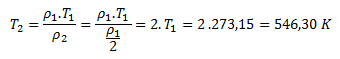
Hustota plynu bude polovičná pri teplote 546,3 K, t.j. 273,15 °C.
7.Vyčíslite relatívnu molekulovú hmotnosť plynnej látky, ktorej relatívna hustota oproti vzduchu je 1,586.
Riešenie:
Relatívna hustota plynu je daná vzťahom:
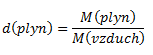
Z toho molová hmotnosť plynu:
M(plyn)=d(plyn).M(vzduch)=1,586 .28,950=45,915 g.mol-1
Relatívna molekulová hmotnosť plynnej látky je 45,915.
8.Aká je relatívna hustota zemného plynu v porovnaní so vzduchom, ak tento plyn obsahuje 75 obj.% CH4, 15 obj.% C2H4, 7 obj.% H2, 1 obj.% CO a 2 obj.% CO2.
Riešenie:
Pre výpočet relatívnej hustoty musíme vypočítať mólovú hmotnosť plynu:
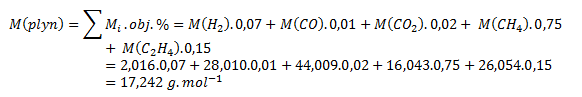
Relatívna hustota zemného plynu:
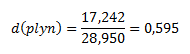
Relatívna hustota zemného plynu v porovnaní so vzduchom je 0,595.
9.1 m3 kyslíka má hmotnosť 1,43 kg pri teplote 0°C a tlaku 101,325 kPa. Vypočítajte hustotu kyslíka pri teplote 23°C a tlaku 95,99 kPa.
Riešenie:
Hodnoty zo zadania spolu s molovou hmotnosťou kyslíka M(O2) = 31,998 g.mol-1 dosadíme do vzorca:
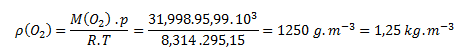
Hustota kyslíka je za zadaných podmienok 1,25 kg.m-3.
10.1 m3 plynu á hmotnosť 1,33 kg pri 100 kPa a 17°C. Aká bude hmotnosť 500 ml plynu pri 85,33 kPa a 37°C?
Riešenie:
Ako prvé potrebujeme zistiť mólovú hmotnosť plynu zo známych údajov prvého systému pri 17°C
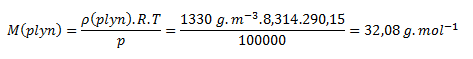
Rovnicu pre výpočet hustoty zo stavovej rovnice upravíme na tvar:
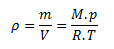
Z ktorej vypočítame hmotnosť:
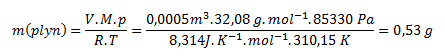
Hmotnosť plynu za zadaných podmienok je 0,53 g.