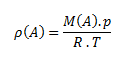Berechnungen für reine Verbindungen
Am Anfang dieses Kapitels konzentrieren wir uns auf die grundlegenden Zusammenhänge, die für chemische Berechnungen erforderlich sind. Wir werden ihre Einheiten, Notation und Berechnung definieren. Ich setze grundlegende Kenntnisse über Einheiten sowie chemische und physikalische Konzepte voraus.
In der chemischen Praxis arbeiten wir mit unterschiedlichen Stoffmengen. Die Stoffmenge kann in Bezug auf die Anzahl der Teilchen, die Masse des Stoffes oder sein Volumen ausgedrückt werden.
Stoffmenge n bestimmt die Menge eines chemisch homogenen Stoffes anhand der Anzahl seiner Grundeinheiten (Teilchen). Die Einheit der Stoffmenge ist das Mol (mol). Ein Mol ist die Stoffmenge eines Systems, das genau so viele elementare Teilchen enthält, wie Atome in 0,012 kg (genau) des Kohlenstoff-12-Nuklids vorhanden sind. Die Konstante, die die Anzahl der Teilchen in einem Mol angibt, ist die Avogadro-Konstante NA = 6,022 × 1023 mol-1.
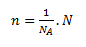
wobei NA die Anzahl der Teilchen in einem Mol Stoff und N eine beliebige Teilchenzahl ist.
Relative Atommasse Ar eines Elements drückt das Verhältnis der durchschnittlichen Masse eines Atoms des Elements zur atomaren Masseneinheit μ = 1,66056 × 10-27 kg aus. Die atomare Masseneinheit entspricht 1/12 der Masse eines neutralen Kohlenstoffatoms.
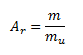
Molmasse ist die Masse von einem Mol einer chemisch reinen Substanz. Im SI-System ist die Einheit kg·mol-1, in der Praxis wird jedoch meist g·mol-1 verwendet.
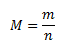
wobei m die Masse der Substanz in Gramm und n die Stoffmenge in Mol ist.
Molvolumen einer Substanz Vm wird definiert als das Verhältnis ihres Volumens V zur Stoffmenge n.
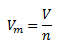
Das Molvolumen einer Substanz unter Normalbedingungen (273,15 K und 101325 Pa) wird als normales Molvolumen Vmn bezeichnet. Im Fall eines idealen Gases beträgt der Wert des normalen Molvolumens Vmn = 22,41 dm3·mol-1. (Dies ist das Avogadro-Gesetz, nach dem gleiche Volumina verschiedener Gase bei gleichem Druck und gleicher Temperatur die gleiche Anzahl von Molekülen enthalten.)
Die ideale Gasgleichung wird im Physikabschnitt der Website erklärt.
p·V = n·R·T
Für ein ideales Gas gelten auch folgende Gesetze:
Boyle-Mariotte-Gesetz, nach dem das Produkt aus Druck und Volumen einer gegebenen Gasmenge bei konstanter Temperatur konstant ist
p·V = const, oder p0V0 = p1V1
Gay-Lussac-Gesetz, das die lineare Zunahme des Gasvolumens in Abhängigkeit von der Temperatur bei konstantem Druck ausdrückt
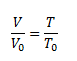
Gesetz von Charles, das die lineare Zunahme des Gasdrucks in Abhängigkeit von der Temperatur bei konstantem Volumen beschreibt
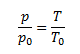
Dalton-Gesetz – der Gesamtdruck p eines Gasgemisches ist gleich der Summe der Partialdrücke aller seiner Komponenten
p = ∑pi bei konstanter Temperatur
Der Partialdruck der i-ten Komponente pi ist der Druck, den die Komponente hätte, wenn sie allein das gesamte Volumen des Systems bei gegebener Temperatur einnehmen würde. Für den Partialdruck einer Komponente gilt:
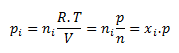
wobei ni die Stoffmenge der i-ten Komponente, n die Stoffmenge des Gemisches und xi der Molenbruch der i-ten Komponente ist.
Dichte einer Substanz ist das Verhältnis der Masse der Substanz zu ihrem Volumen. Die Einheit der Dichte im SI-System ist Kilogramm pro Kubikmeter, kg·m-3, oder Gramm pro Kubikzentimeter g·cm-3.
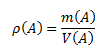
Die Beziehung für die Gasdichte kann aus der Zustandsgleichung abgeleitet werden: