Ionengleichungen
Ion ist ein Atom oder Molekül mit einer von null verschiedenen Ladung, das heißt die Gesamtzahl seiner Elektronen ist nicht gleich der Anzahl seiner Protonen. Die Neigung, Ionen zu bilden, hängt von der Elektronegativität der einzelnen Elemente ab. Wenn die Anzahl der Elektronen die Anzahl der Protonen übersteigt, ist das Atom oder Molekül negativ geladen. Ein solches Teilchen nennt man Anion. Übersteigt die Anzahl der Protonen die Anzahl der Elektronen, ist das Teilchen positiv geladen und wir nennen es ein Kation.
Ionen werden unterschieden in einatomige (Na+, Cl-, Cu2+, Ir3+…), molekulare (OH-, CO32-, HS-…) und komplexe ([Fe(CN)6]4-, [Cu(H2O)6]2+, [Cu(H2O)2(NH3)4]2+, [HgI4]2-…).
Ionen-Gleichungen sind chemische Gleichungen, die Reaktionen von Ionen in wässrigen Lösungen von Säuren, Basen und Salzen beschreiben. Damit diese Reaktionen ablaufen, muss mindestens eine der folgenden Bedingungen erfüllt sein:
- Es bildet sich ein Niederschlag (unlösliche Substanz)
- Es bildet sich ein schwacher Elektrolyt
- Es bildet sich ein Gas
- Die Oxidationszahlen der Atome ändern sich
Schwache Elektrolyte (NH4OH, H2S, HCN, H2O…), Gase (CO2, SO2, SO3, NH3, Cl2, NO…) und Niederschläge (AgBr, CaCO3, AgCl, PbI2…) schreiben wir als ganze Moleküle.
1. Schreibe die gegebene chemische Gleichung in Ionenform:
Lösung:
Wir können nur die Formeln starker Säuren, Basen und im Wasser gut löslicher Salze als Ionen schreiben. Andere Substanzen sind nicht dissoziiert:
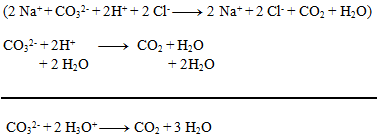
2.
Schreibe die Ionen-Gleichung der Fällungsreaktion von Schwefelsäure mit Bariumchlorid.
Lösung:
Zuerst schreiben wir die Gleichung in stöchiometrischer Form:
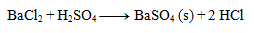
Als Nächstes schreiben wir die Dissoziationen:
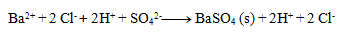
Endgültige Gleichung:
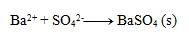
3.
Die folgenden Gleichungen sind Fällungsreaktionen. Schreibe sie in Ionenform:
Lösung:
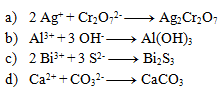
4.
Die folgenden Gleichungen stellen Komplexbildungsreaktionen dar. Schreibe sie in Ionenform:
Lösung:
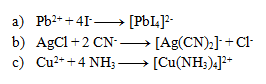
5.
Gleiche die folgenden Ionen-Gleichungen aus. Achte dabei nicht nur auf die Summen der Atome, sondern auch auf die Ladungssumme auf beiden Seiten.
Lösung:
- a) 1,2,1,6,4
- b) 1,1,2,1,1
- c) 2,1,4,1,1,2
- d) 1,1,1,1,2
- e) 2,1,4,1,1,2
- f) 3,2,1,2
- g) 1,1,2,1,1,1
6. Schreibe die Ionen-Gleichung und die Nettogleichung der Reaktion von Natriumchlorid mit Silbernitrat.
Lösung:
Zuerst schreiben und wichten wir die stöchiometrische Gleichung:
AgNO3 + NaCl → AgCl↓ + NaNO3
Als Nächstes schreiben wir alle Verbindungen in Ionenform, mit Ausnahme des Niederschlags:
Ag+ + NO3- + Na+ + Cl- → AgCl↓ + Na+ + NO3-
Wenn wir Ionen, die auf beiden Seiten der Gleichung vorkommen (Zuschauerionen), weglassen, erhalten wir die Nettogleichung:
Ag+ + Cl- → AgCl↓
7. Bestimme die stöchiometrischen Koeffizienten in der folgenden chemischen Gleichung:
[SnCl3]– + H2O → [Sn3(OH)4]2+ + H3O+ + Cl–
Lösung:
In dieser chemischen Gleichung ändern sich die Oxidationszahlen aller Atome nicht, es ist also keine Redoxreaktion. Wir wählen die Verbindung mit den größten stöchiometrischen Indizes und setzen ihren Koeffizienten auf 1; in diesem Fall das Produkt [Sn3(OH)4]2+. Auf der rechten Seite stehen drei Zinnatome, daher setzen wir vor [SnCl3]– den Koeffizienten 3:
3[SnCl3]– + H2O → [Sn3(OH)4]2+ + H3O+ + Cl–
Auf der linken Seite ergeben sich dadurch 9 Chloratome, also setzen wir vor Cl– den Koeffizienten 9:
3[SnCl3]– + H2O → [Sn3(OH)4]2+ + H3O+ + 9Cl–
Die Koeffizienten für Wasser und Hydronium-Ion müssen noch bestimmt werden. Mithilfe des Ladungsausgleichs: linke Seite = –3, rechte Seite (ohne H3O+) = –7. Daher muss der Koeffizient von H3O+ 4 sein, um die Ladungen auszugleichen:
3[SnCl3]– + H2O → [Sn3(OH)4]2+ + 4H3O+ + 9Cl–
Auf der rechten Seite gibt es nun 16 Wasserstoffatome, also muss der Koeffizient für H2O 8 sein:
3[SnCl3]– + 8H2O → [Sn3(OH)4]2+ + 4H3O+ + 9Cl–
8. Die Reaktion von Bariumchlorid mit Magnesiumsulfat erzeugt einen Niederschlag von Bariumsulfat. Schreibe die Nettogleichung dieses Prozesses.
Lösung:
Zuerst schreiben wir die vollständige chemische Gleichung:
BaCl2 + MgSO4 → BaSO4 + MgCl2
Da die Reaktion in Lösung stattfindet, sind Ionen frei beweglich. BaSO4 ist ein Niederschlag, schlecht wasserlöslich, daher schreiben wir es nicht als Ionen:
Ba2+ + 2Cl- + Mg2+ + SO42- → BaSO4↓ + Mg2+ + 2Cl-
Nach dem Weglassen der Zuschauerionen erhalten wir die Nettogleichung:
Ba2+ + SO42- → BaSO4↓
9. Das Auflösen des Calciumphosphat-Niederschlags mit Salpetersäure kann geschrieben werden als:
Ca3(PO4)2↓ + 6HNO3 → 3Ca(NO3)2 + 2H3PO4
Schreibe die Ionen- und die Nettogleichungen für diese Reaktion.
Lösung:
Ionen-Gleichung:
Ca3(PO4)2↓ + 6H+ + 6NO3- → 3Ca2+ + 6NO3- + 6H+ + 2PO42-
Nettogleichung:
Ca3(PO4)2↓ → 3Ca2+ + 2PO42- oder Ca3(PO4)2↓ + 6H+ → 3Ca2+ + 2H3PO4
10. Schreibe die Ionen-Gleichung der Reaktion von Natriumhydroxid mit Schwefelsäure.
Lösung:
Zuerst schreiben und wichten wir die vollständige chemische Gleichung:
H2SO4 + 2NaOH → Na2SO4 + 2H2O
Beide Reaktanten sind in Lösung vollständig dissoziiert. Natriumsulfat ist ebenfalls löslich. Wasser gilt als schwacher Elektrolyt, daher dissoziieren wir es nicht:
2H+ + SO42- + 2Na+ + 2OH- → 2Na+ + SO42- + 2H2O
Diese Neutralisation kann in der allgemeinen Form jeder Neutralisation geschrieben werden als:
H+ + OH- → H2O
11. Gleiche die folgenden Ionenreaktionen aus und achte darauf, die Gesamtladung der Reaktanten und Produkte zu erhalten, nicht nur die Atomstöchiometrie:
P3- + H2O → PH3 + OH-
Au3+ + Cl- → [AuCl4]-
As2S3 + OH- → AsO2- + AsS2- + H2O
[Cu(H2O)6]2+ + Cl- → [CuCl4]2- + H2O
VO43- + H+ → V3O93- + H2O
CrCl2O2 + OH- → CrO42- + Cl- + H2O
HPO42- + MoO42- + H+ → [P(Mo3O10)4]3- + H2O
[Al(H2O)4(OH)2]+ + CO32- → [Al(H2O)3(OH)3] + HCO3-
Lösung:
P3- + 3H2O → PH3 + 3OH-
Au3+ + 4Cl- → [AuCl4]-
2As2S3 + 4OH- → AsO2- + 3AsS2- + 2H2O
[Cu(H2O)6]2+ + 4Cl- → [CuCl4]2- + 6H2O
3VO43- + 6H+ → V3O93- + 3H2O
CrCl2O2 + 4OH- → CrO42- + 2Cl- + 2H2O
HPO42- + 12MoO42- + 23H+ → [P(Mo3O10)4]3- + 12H2O
[Al(H2O)4(OH)2]+ + CO32- → [Al(H2O)3(OH)3] + HCO3-