Stoffmenge
1. Berechne die Anzahl der Stickstoffmonoxid-Moleküle in einem Behälter, der 4,5 mol dieses Gases enthält.
Lösung:
Wir beginnen mit der Gleichung zur Berechnung der Stoffmenge:
N(NO) = n(NO).NA = 4,5 mol × 6,022 × 1023 = 2,7 × 1024
Der Behälter enthält 2,7 × 1024 NO-Moleküle.
2. Welche Stoffmenge entspricht 1,806 × 1027 Kohlenstoffatomen?
Lösung:
Wir verwenden die Beziehung für die Stoffmenge.
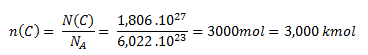
Die Stoffmenge an Kohlenstoff, die 1,806 × 1027 Atome enthält, beträgt 3 kmol.
3. Wie viele Moleküle befinden sich in einem Behälter, der 2,5 mol Kohlendioxid enthält?
Lösung:
Wir verwenden ein ähnliches Verfahren wie im Beispiel 2.
1,5 × 1024 Moleküle.
4. Berechne die Stoffmenge:
- a) 2,58 × 1027 Atome Aluminium
- b) 5,55 × 1019 Natrium-Kationen
- c) 8,68 × 1022 Chlorid-Anionen
- d) 1,75 × 1025 Moleküle weißen Phosphors (P4)
Lösung:
Wir verwenden das gleiche Verfahren wie im Beispiel 2.
- a) 4,28 kmol
- b) 9,22 × 10-2 mmol
- c) 0,144 mol
- d) 29,1 mol
5. Die Ladung eines Elektrons beträgt 1,6 × 10-19 C. Wie groß ist die Ladung von 1 mol Elektronen (Faraday-Konstante)?
Lösung:
Nach der Avogadro-Konstante enthält 1 mol 6,022 × 1023 Teilchen. Jedes Teilchen, in unserem Fall das Elektron, trägt eine Ladung von 1,6 × 10-19 C. Ein Mol Elektronen trägt somit eine Ladung von 1,6 × 10-19 × 6,022 × 1023, was 96352 C ergibt.
6. Wie viele Silberatome sind in 1 cm3 dieses Metalls enthalten, das eine Dichte von ρ = 10,5 × 103 kg·m-3 hat?
Lösung:
Aus der Dichte und dem Volumen berechnen wir die Masse des Silbers:
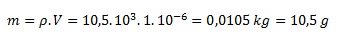
Die Molmasse von Ag beträgt 107,868 g/mol, daher gilt für die Stoffmenge an Silber:
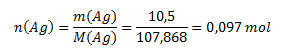
und für die Anzahl der Teilchen:
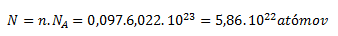
1 cm3 Silber enthält 5,86 × 1022 Atome.
7. Welche Stoffmenge an H2O befindet sich in einem Liter Wasser?
Lösung:
Die Dichte von Wasser beträgt 1 g/cm3, daher wiegt 1 Liter Wasser 1 kg, also 1000 g. Die Molmasse von Wasser beträgt 18 g/mol, daher beträgt die Stoffmenge:
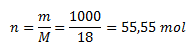
Ein Liter Wasser enthält 55,5 mol H2O-Moleküle.
8. Welche Stoffmenge Natrium ist in 10 g NaCl enthalten? Wie viele Chloratome entsprechen dieser Menge Natrium in der Verbindung?
Lösung:
Das Verfahren ist ähnlich wie in Beispiel 6.
0,17 mol Na; 1,03 × 1023 Cl-Atome
9. Welche Stoffmenge entspricht 1 g H2SO4 und 200 g CH4?
Lösung:
Das Verfahren ist ähnlich wie in Beispiel 6.
0,01 mol; 12,47 mol
10. Welche Menge Aluminium befindet sich in einem Würfel mit einer Kantenlänge von 10 cm? (verwende Daten aus chemischen Tabellen)
Lösung:
Verfahren wie in Beispiel 6.
100,07 mol