Aggregatzustände
1.Erklären Sie die Aggregatzustände und ihre Änderungen!
Lösung:
Stoffe können in drei Zuständen (Phasen) vorkommen – fest, flüssig und gasförmig.
Schmelzen – Übergang von fest zu flüssig
Erstarren – Übergang von flüssig zu fest
Verdampfen – Übergang von flüssig zu gasförmig
Sieden – Verdampfen, wenn der Dampfdruck dem Außendruck entspricht
Kondensation – Übergang von gasförmig zu flüssig
Sublimation – direkter Übergang von fest zu gasförmig
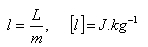
L = latente Wärme (Schmelzen, Erstarren, Verdampfen, Sieden ...)
l = spezifische latente Wärme (Schmelzen, Erstarren, Verdampfen, Sieden ...)
m = Masse des Stoffes
Für Eis – Wasser – Dampf gilt:
t melt = t freeze = 00C, t boil = t condense = 1000C,
l melt = l freeze = 334.103J.kg-1, l boil = l condense = 2260.103J.kg-1
l evap(200C) = 2430.103J.kg-1, l sub = 2830.103J.kg-1
c(H2O) = 4180 J.kg-1.K-1, c(Eis) = 2100 J.kg-1.K-1
Umwandlung von Eis zu Dampf: Q = Q1 + L1 + Q2 + L2 + Q3
Q1 = Wärme zum Erwärmen des Eises bis zum Schmelzpunkt
L1 = Wärme zum Übergang von Eis zu Wasser
Q2 = Wärme zum Erwärmen des Wassers bis zum Siedepunkt
L2 = Wärme zum Übergang von Wasser zu Dampf
Q3 = Wärme zum Erwärmen des Dampfes
2.Berechnen Sie die zum Schmelzen eines Aluminiumkörpers mit einer Masse von 10 kg und einer Anfangstemperatur von 200C erforderliche Wärme. Benutzen Sie die Tabellen.
Lösung:
Analyse:
m = 10 kg, t1 = 200C, tm (Al) = 6600C, c(Al) = 896 J.kg-1.K-1
lm (Al) = 400.103J.kg-1
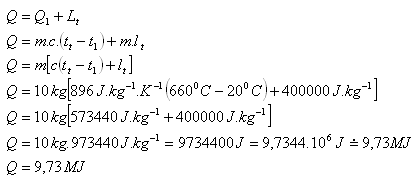
Zum Schmelzen des Aluminiumkörpers werden etwa 9.73 MJ Wärme benötigt.
3.Bestimmen Sie die spezifische Schmelzwärme von Kupfer, wenn bekannt ist, dass zum Schmelzen von 5 kg Kupfer, das auf seinen Schmelzpunkt erhitzt wurde, 1.02 MJ Wärme erforderlich sind.
Lösung:
Analyse:
m = 5 kg, L = 1.02.106J,
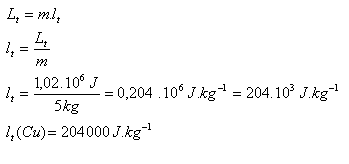
Die spezifische Schmelzwärme von Kupfer beträgt lm (Cu) = 204,000 J.kg-1
4.In 5 Liter Wasser mit 500C wird Eis gegeben. Wie groß muss die Masse dieses Eises sein, damit es vollständig schmilzt und die Endtemperatur des Wassers nach dem Schmelzen 00C beträgt? Benutzen Sie die Tabellen!
Lösung:
Analyse:
m1 = 5 l = 5 kg, t1 = 500C, Δ t = 500C, c1(H2O) = 4180 J.kg-1.K-1
lm (Eis) = 334,000 J.kg-1
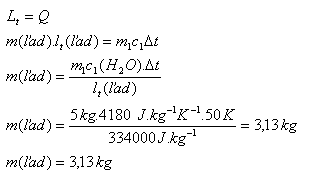
Die Masse des Eises muss m = 3.13 kg betragen.
5.Wasser mit einer Masse von 10 kg und einer Temperatur von 00C wird auf 1000C erhitzt und anschließend bei derselben Temperatur vollständig zu Dampf verdampft. Wie groß ist die insgesamt vom Wasser aufgenommene Wärme? Welcher Prozentsatz dieser Wärme wird zum Erhitzen des Wassers und welcher für den Phasenübergang verwendet? Benutzen Sie die Tabellen!
Lösung:
Analyse:
m = 10 kg, Δt = 1000C = 100 K, c1 = 4180 J.kg-1.K-1,
lv = 2.26.106 J.kg-1