Atomkern
1. Welche Eigenschaften hat der Atomkern?
Lösung:
Der Atomkern bildet den zentralen Teil des Atoms. Er macht fast seine gesamte Masse aus. Der Atomkern enthält Protonen und Neutronen – Nukleonen.
Atomare Konstante:
Proton:
Neutron:
, Z= Protonenzahl (Anzahl der Protonen im Kern, Elektronen in der Hülle, Ordnungszahl des Elements im Periodensystem)
Neutronenzahl (Anzahl der Neutronen im Kern)
Nukleonenzahl A=N+Z (Anzahl der Nukleonen – Protonen und Neutronen im Kern)
Isotope sind Nuklide desselben Elements (gleiches ), die sich in der Neutronenzahl unterscheiden (und damit auch in der Zahl ).
Die Masse des Kerns ist immer kleiner als die Masse von Protonen und Neutronen.
Massendefekt des Kerns:
Bindungsenergie des Kerns:
Bindungsenergie pro Nukleon:
Neue Masseneinheit:
2.Blei hat vier Isotope. Bestimmen Sie die Anzahl der Protonen und Neutronen im Kern.
Lösung:
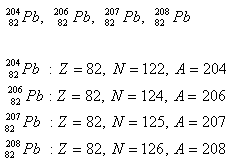
3. Berechnen Sie:
- a.) die Ruhemasse des Stickstoffkerns, gegeben Ar(N) = 14,0067
- b.) die relative Masse des Chlorkerns, gegeben m(Cl) = 5,885·10–26 kg, 1 MeV·c–2 = 1,7825·10–30 kg, mu = 1,6605·10–27 kg
Lösung:
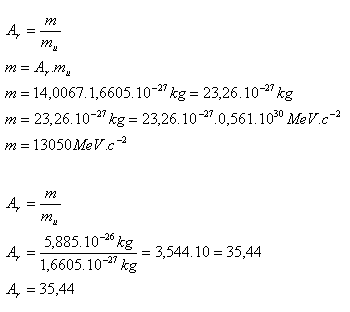
- Die Ruhemasse des Stickstoffkerns ist m = 13 050 MeV·c-2.
- Die relative Masse des Chlorkerns ist Ar = 35.44.
4.Bestimmen Sie den Massendefekt, die Bindungsenergie und die Energie pro Nukleon für einen Radiumkern. Geben Sie die Energie in MeV an.
Lösung:
Analyse:

Der Massendefekt ist Bj = 1708.9 MeV·c-2, die Bindungsenergie ist Ej = 1708.9 MeV, die Energie pro Nukleon ist εj = 7.56 MeV.
5.Bestimmen Sie die prozentuale Zusammensetzung von Chlor mit einer relativen Atommasse von 35,5, das ein Gemisch aus Isotopen ist
Lösung:
Analyse:
x = relative Häufigkeit des ersten Isotops
y = relative Häufigkeit des zweiten Isotops
Chlor enthält 75 % des ersten Isotops und 25 % des zweiten Isotops.
6.In der von den Amerikanern über Hiroshima abgeworfenen Atombombe enthielt die Ladung 44,5 kg Uran. Welche Energie wurde freigesetzt?
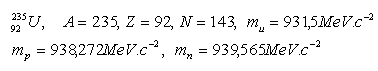
Lösung:
23592U
Energie eines Nukleons:
Masse des Kerns:
Anzahl der Kerne in 1 kg:
Anzahl der Kerne in 44,5 kg Uran:
Gesamtenergie:
Die Gesamtenergie beträgt:
7.Wie lange würde ein Kraftwerk, dessen zwei Blöcke eine Leistung von P = 2,440 MW haben, benötigen, um die Energie aus Aufgabe Nr. 6 (E = 3.24·1016 J) zu erzeugen?
Lösung:
Analyse:
E = 3.24·1016 J, P = 2,440 MW = 880·106 J·s-1, t = ?
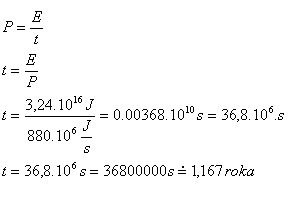
Das Kraftwerk würde diese Energie in 1.167 Jahren erzeugen.
8.Ein Kern mit der Massenzahl 100 und der Bindungsenergie εj1 = 7.4 MeV spaltet sich in zwei Kerne mit der Bindungsenergie pro Nukleon εj2 = 8.2 MeV. Welche Energie wird bei der Reaktion freigesetzt?
Lösung:
Analyse:
A = 100, εj1 = 7.4 MeV, εj2 = 8.2 MeV, Ej = ?
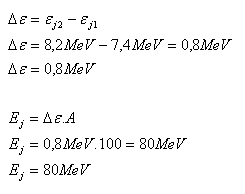
Bei der Reaktion werden 80 MeV Energie freigesetzt.
9.Bestimmen Sie die durch die Spaltung von 1 kg Uran gewinnbare Energie 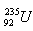 wenn die Spaltung eines Urankerns 200 MeV Energie freisetzt. Welche Masse an Steinkohle mit einem Heizwert von 3·107 J·kg würde benötigt, um die gleiche Energie zu erhalten?
wenn die Spaltung eines Urankerns 200 MeV Energie freisetzt. Welche Masse an Steinkohle mit einem Heizwert von 3·107 J·kg würde benötigt, um die gleiche Energie zu erhalten?
Lösung:

Die Masse der Steinkohle müsste M = 2,733 Tonnen betragen.
10.Ein Block eines Kernkraftwerks, der Kernenergie mit einem Wirkungsgrad von 40% in elektrische Energie umwandelt, hat eine elektrische Leistung von 600 MW. Bestimmen Sie die Masse an Uran 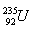 die in 24 Stunden verbraucht wird, wenn bei der Spaltung eines einzelnen Kerns 200 MeV Energie freigesetzt werden.
die in 24 Stunden verbraucht wird, wenn bei der Spaltung eines einzelnen Kerns 200 MeV Energie freigesetzt werden.
Lösung:
Analyse:
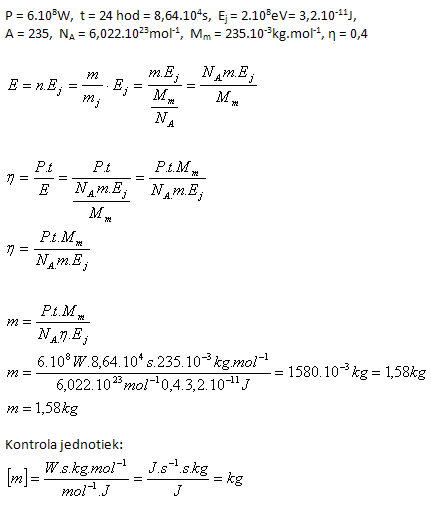
Die Masse an Uran beträgt 1.58 kg.
11.Zeigen Sie, dass für die in der Atomphysik verwendeten Masseneinheiten Folgendes gilt:
Lösung:
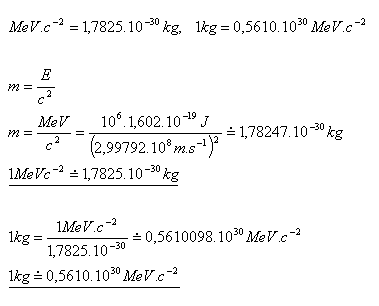
12.Drücken Sie die Masse der Atommassekonstante mu, des Protons mp und des Neutrons mn in Einheiten von MeV c–2 aus.
Lösung:
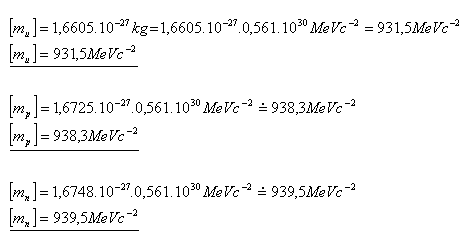
Die Masse der Atommassekonstante ist mu = 931.5 MeV c–2,
die des Protons mp = 938.3 MeV c–2 und die des Neutrons mn = 939.5 MeV c–2.
13.Bestimmen Sie die Bindungsenergie des Kohlenstoffkerns pro Nukleon.
Lösung:
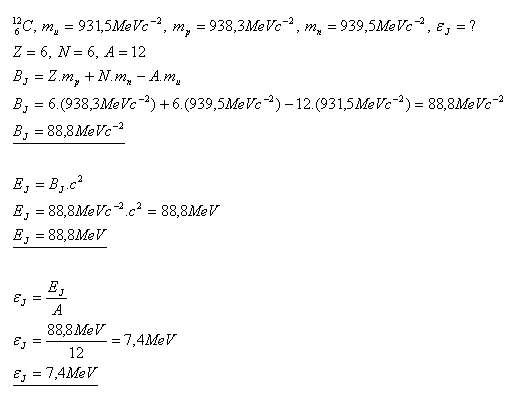
Die Bindungsenergie des Kohlenstoffkerns pro Nukleon beträgt ε = 7.4 MeV.
14.Bestimmen Sie die Anzahl der Uranatome in 1 kg Uran.
Lösung:
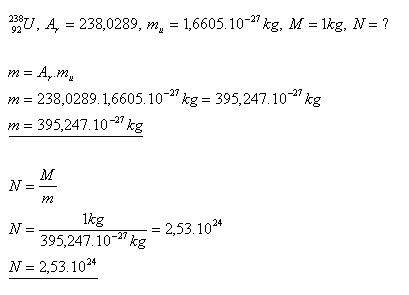
In 1 Kilogramm Uran gibt es N = 2.53×1024 Uranatome.
15.Finden Sie heraus, wie viele Protonen und wie viele Neutronen in 1 kg Neon enthalten sind.
Lösung:
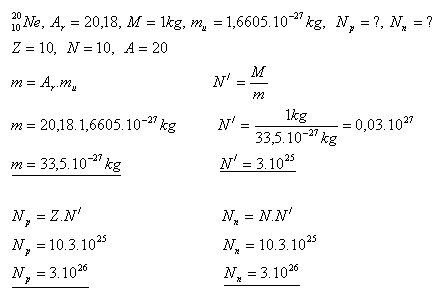
In einem Kilogramm Neon gibt es 3×1026 Protonen und 3×1026 Neutronen.
16.Bestimmen Sie die gesamte Bindungsenergie der Kerne in einem Kilogramm Uran. Ein Kilogramm Uran enthält 2.53×1024 Atome.
Lösung:

Die gesamte Bindungsenergie der Urankerne beträgt E = 7.3×1014 J.
17.Berechnen Sie die Größe der elektrischen Kraft
- a.) mit der sich zwei Protonen im Kern abstoßen (r = 10–15 m)
- b.) mit der sich ein Proton und ein Elektron anziehen (r = 10–10 m)
Lösung:
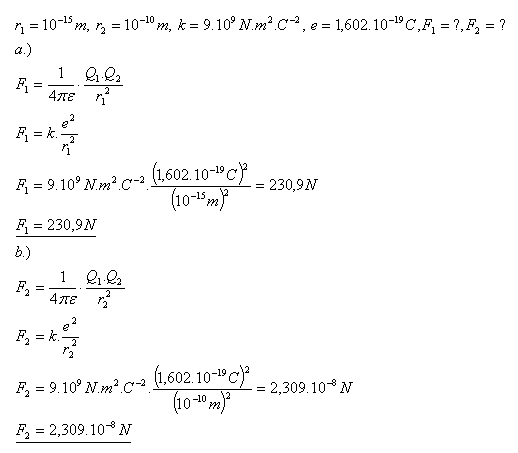
Die Kräfte sind F1 = 230.9 N und F2 = 2.309×10–8 N.
18.Ein Kern mit der Massenzahl A = 230 und der Bindungsenergie pro Nukleon
εj1 = 7.4 MeV spaltet sich in zwei Kerne mit Bindungsenergie pro Nukleon εj2 = 8.3 MeV. Welche Energie wird bei der Spaltung freigesetzt?
Lösung:
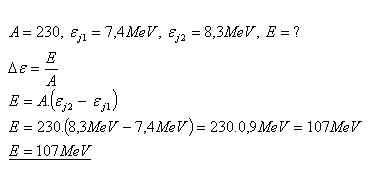
Bei der Spaltung wird Energie E = 107 MeV freigesetzt.
19.Bor, wie es in der Natur vorkommt, ist eine Mischung aus zwei Isotopen. Die mittlere Atommasse von Bor beträgt 10.82 mu. Wie viel Prozent jedes Isotops sind im natürlichen Bor enthalten, wenn:
Lösung:
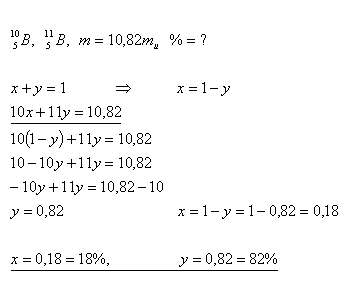
Natürliches Bor enthält 18% des ersten Isotops und 82% des zweiten Isotops.
20.Vergleichen Sie die Dichte des Wasserstoffkerns mit der Dichte von Wasser.
Lösung:
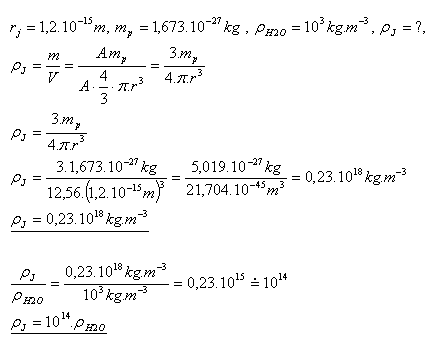
Die Dichte des Wasserstoffkerns ist etwa 1014-mal größer als die Dichte von Wasser.